Номер 5, страница 51 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §12. Соединения галогенов. Часть 1 - номер 5, страница 51.
№5 (с. 51)
Условие. №5 (с. 51)
скриншот условия


5. Растворы галогеноводородов проявляют свойства, типичные для кислот. Напишите в молекулярной и ионной форме уравнения реакций растворов галогеноводородов:
1) с металлами:
2) с основными и амфотерными оксидами:
a)
б)
3) с основаниями и амфотерными гидроксидами:
a)
б)
4) с солями с образованием газа ($\uparrow$) или осадка ($\downarrow$):
a)
б)
5) HF взаимодействует с $SiO_2$:
Решение. №5 (с. 51)

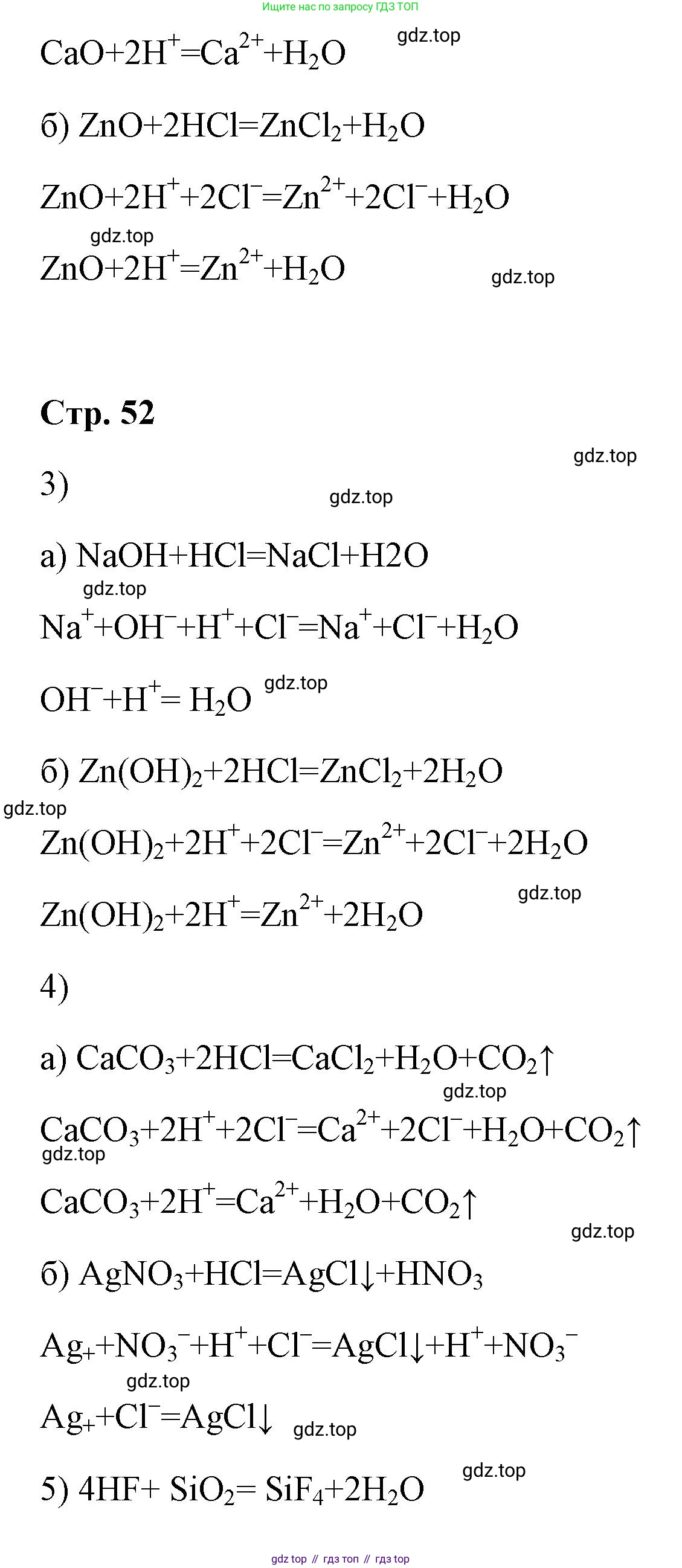
Решение 2. №5 (с. 51)
1) с металлами:
Галогеноводородные кислоты реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода. В результате реакции образуется соль и выделяется газообразный водород. В качестве примера рассмотрим реакцию соляной кислоты с цинком.
Молекулярное уравнение:
$Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
Полное ионное уравнение:
$Zn^0 + 2H^+ + 2Cl^- \rightarrow Zn^{2+} + 2Cl^- + H_2^0 \uparrow$
Сокращенное ионное уравнение:
$Zn^0 + 2H^+ \rightarrow Zn^{2+} + H_2^0 \uparrow$
Ответ: $Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$; $Zn^0 + 2H^+ \rightarrow Zn^{2+} + H_2^0 \uparrow$.
2) с основными и амфотерными оксидами:
а) Реакция с основным оксидом. Галогеноводородные кислоты реагируют с основными оксидами с образованием соли и воды. Пример: взаимодействие оксида меди(II) с соляной кислотой.
Молекулярное уравнение:
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
Полное ионное уравнение:
$CuO + 2H^+ + 2Cl^- \rightarrow Cu^{2+} + 2Cl^- + H_2O$
Сокращенное ионное уравнение:
$CuO + 2H^+ \rightarrow Cu^{2+} + H_2O$
Ответ: $CuO + 2HCl \rightarrow CuCl_2 + H_2O$; $CuO + 2H^+ \rightarrow Cu^{2+} + H_2O$.
б) Реакция с амфотерным оксидом. Амфотерные оксиды реагируют с сильными кислотами с образованием соли и воды. Пример: взаимодействие оксида цинка с бромоводородной кислотой.
Молекулярное уравнение:
$ZnO + 2HBr \rightarrow ZnBr_2 + H_2O$
Полное ионное уравнение:
$ZnO + 2H^+ + 2Br^- \rightarrow Zn^{2+} + 2Br^- + H_2O$
Сокращенное ионное уравнение:
$ZnO + 2H^+ \rightarrow Zn^{2+} + H_2O$
Ответ: $ZnO + 2HBr \rightarrow ZnBr_2 + H_2O$; $ZnO + 2H^+ \rightarrow Zn^{2+} + H_2O$.
3) с основаниями и амфотерными гидроксидами:
а) Реакция с основанием (реакция нейтрализации). Кислоты реагируют с основаниями с образованием соли и воды. Пример: взаимодействие соляной кислоты с гидроксидом натрия.
Молекулярное уравнение:
$HCl + NaOH \rightarrow NaCl + H_2O$
Полное ионное уравнение:
$H^+ + Cl^- + Na^+ + OH^- \rightarrow Na^+ + Cl^- + H_2O$
Сокращенное ионное уравнение:
$H^+ + OH^- \rightarrow H_2O$
Ответ: $HCl + NaOH \rightarrow NaCl + H_2O$; $H^+ + OH^- \rightarrow H_2O$.
б) Реакция с амфотерным гидроксидом. Амфотерные гидроксиды, проявляя основные свойства, реагируют с кислотами. Пример: взаимодействие гидроксида алюминия с соляной кислотой.
Молекулярное уравнение:
$Al(OH)_3 + 3HCl \rightarrow AlCl_3 + 3H_2O$
Полное ионное уравнение:
$Al(OH)_3 \downarrow + 3H^+ + 3Cl^- \rightarrow Al^{3+} + 3Cl^- + 3H_2O$
Сокращенное ионное уравнение:
$Al(OH)_3 \downarrow + 3H^+ \rightarrow Al^{3+} + 3H_2O$
Ответ: $Al(OH)_3 + 3HCl \rightarrow AlCl_3 + 3H_2O$; $Al(OH)_3 \downarrow + 3H^+ \rightarrow Al^{3+} + 3H_2O$.
4) с солями с образованием газа (↑) или осадка (↓):
а) Реакция с солью с образованием газа. Происходит, если в результате реакции образуется летучее соединение (например, $CO_2$, $SO_2$, $H_2S$). Пример: взаимодействие соляной кислоты с карбонатом натрия.
Молекулярное уравнение:
$Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2 \uparrow$
Полное ионное уравнение:
$2Na^+ + CO_3^{2-} + 2H^+ + 2Cl^- \rightarrow 2Na^+ + 2Cl^- + H_2O + CO_2 \uparrow$
Сокращенное ионное уравнение:
$CO_3^{2-} + 2H^+ \rightarrow H_2O + CO_2 \uparrow$
Ответ: $Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2 \uparrow$; $CO_3^{2-} + 2H^+ \rightarrow H_2O + CO_2 \uparrow$.
б) Реакция с солью с образованием осадка. Происходит, если один из продуктов реакции является нерастворимым веществом. Пример: взаимодействие соляной кислоты с нитратом серебра (качественная реакция на хлорид-ион).
Молекулярное уравнение:
$HCl + AgNO_3 \rightarrow AgCl \downarrow + HNO_3$
Полное ионное уравнение:
$H^+ + Cl^- + Ag^+ + NO_3^- \rightarrow AgCl \downarrow + H^+ + NO_3^-$
Сокращенное ионное уравнение:
$Ag^+ + Cl^- \rightarrow AgCl \downarrow$
Ответ: $HCl + AgNO_3 \rightarrow AgCl \downarrow + HNO_3$; $Ag^+ + Cl^- \rightarrow AgCl \downarrow$.
5) HF взаимодействует с SiO₂:
Фтороводородная (плавиковая) кислота обладает уникальным свойством реагировать с оксидом кремния(IV), который является основным компонентом стекла. Эта реакция лежит в основе процесса травления стекла.
Молекулярное уравнение:
$SiO_2 + 4HF \rightarrow SiF_4 \uparrow + 2H_2O$
Ионные уравнения для этой реакции обычно не составляют, так как $SiO_2$ – твердое вещество с ковалентной кристаллической решеткой, $HF$ – слабая кислота, а $SiF_4$ – газ.
Ответ: $SiO_2 + 4HF \rightarrow SiF_4 \uparrow + 2H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 51 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 51), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















