Номер 5, страница 104 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §24. Кремний и его соединения. Часть 2 - номер 5, страница 104.
№5 (с. 104)
Условие. №5 (с. 104)
скриншот условия

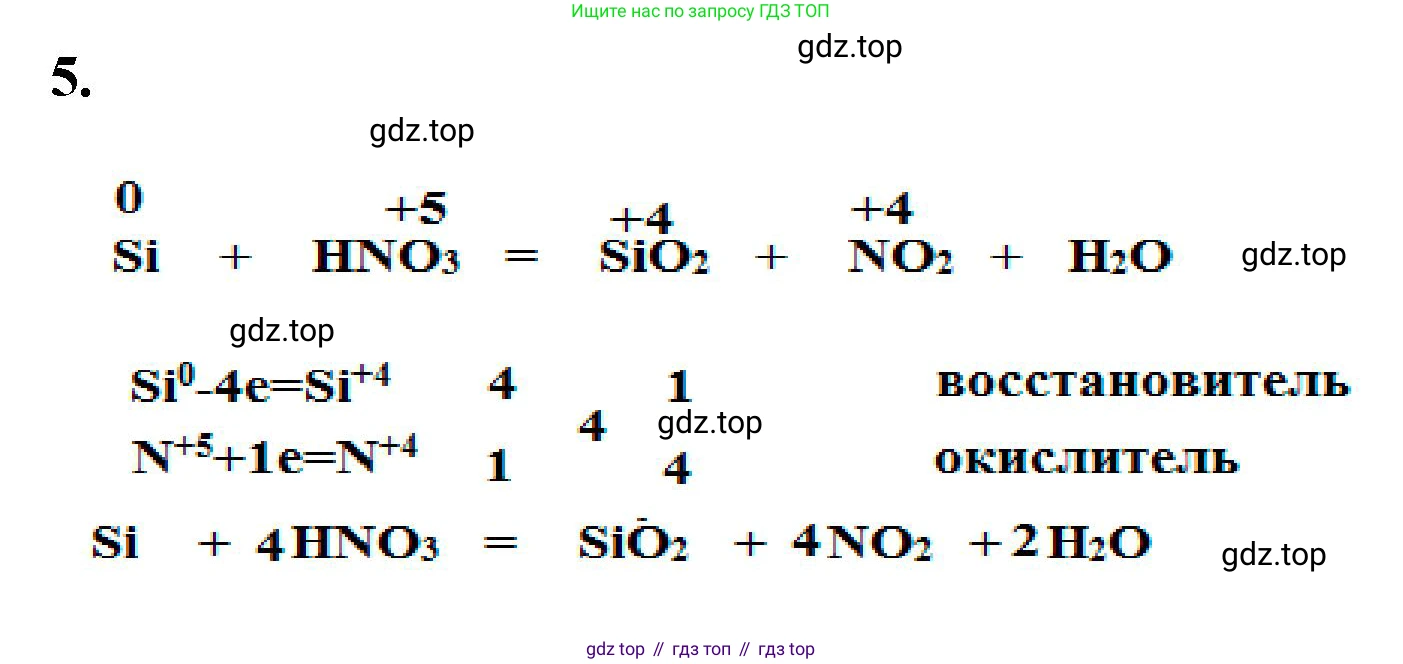
5. Дополните схему. Расставьте коэффициенты с помощью метода электронного баланса.
$Si + HNO_3 = SiO_2 + NO_2 + \text{_____}$
Решение. №5 (с. 104)
Решение 2. №5 (с. 104)
Дополните схему.
В левой части уравнения (реагенты) находятся атомы кремния (Si), водорода (H), азота (N) и кислорода (O). В правой части в уже указанных продуктах ($SiO_2$ и $NO_2$) присутствуют атомы кремния, азота и кислорода. Атомы водорода из азотной кислоты ($HNO_3$) должны войти в состав еще одного продукта. В реакциях с кислотами-окислителями таким продуктом, как правило, является вода ($H_2O$).
Следовательно, полная схема реакции выглядит так:
$Si + HNO_3 \rightarrow SiO_2 + NO_2 + H_2O$
Расставьте коэффициенты с помощью метода электронного баланса.
1. Определяем степени окисления элементов, которые их изменяют в ходе реакции:
$\stackrel{0}{Si} + H\stackrel{+1}{}\stackrel{+5}{N}\stackrel{-2}{O_3} \rightarrow \stackrel{+4}{Si}\stackrel{-2}{O_2} + \stackrel{+4}{N}\stackrel{-2}{O_2} + \stackrel{+1}{H_2}\stackrel{-2}{O}$
Изменяют степени окисления кремний (с 0 до +4, окисляется) и азот (с +5 до +4, восстанавливается).
2. Составляем электронный баланс, чтобы уравнять число отданных и принятых электронов:
$\stackrel{0}{Si} - 4e^- \rightarrow \stackrel{+4}{Si}$ | 1 | процесс окисления, Si - восстановитель
$\stackrel{+5}{N} + 1e^- \rightarrow \stackrel{+4}{N}$ | 4 | процесс восстановления, $N^{+5}$ (в $HNO_3$) - окислитель
Наименьшее общее кратное для отданных (4) и принятых (1) электронов равно 4. Полученные множители (1 и 4) являются стехиометрическими коэффициентами в уравнении реакции.
3. Подставляем коэффициенты в уравнение. Ставим коэффициент 1 перед веществами, содержащими кремний ($Si$ и $SiO_2$), и коэффициент 4 — перед веществами, содержащими азот ($HNO_3$ и $NO_2$). Коэффициент 1 обычно не пишется.
$Si + 4HNO_3 \rightarrow SiO_2 + 4NO_2 + H_2O$
4. Уравниваем количество атомов водорода. В левой части в $4HNO_3$ содержится 4 атома водорода. Чтобы получить 4 атома водорода в правой части, ставим коэффициент 2 перед $H_2O$.
$Si + 4HNO_3 \rightarrow SiO_2 + 4NO_2 + 2H_2O$
5. Проверяем баланс атомов кислорода для контроля:
Слева: в $4HNO_3$ содержится $4 \times 3 = 12$ атомов кислорода.
Справа: в $SiO_2$ — 2 атома, в $4NO_2$ — $4 \times 2 = 8$ атомов, в $2H_2O$ — 2 атома. Сумма: $2 + 8 + 2 = 12$ атомов кислорода.
Количество всех атомов в левой и правой частях уравнения равно. Коэффициенты расставлены верно.
Ответ: $Si + 4HNO_3 = SiO_2 + 4NO_2 + 2H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 104 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 104), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















