Номер 4, страница 102 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §24. Кремний и его соединения. Часть 1 - номер 4, страница 102.
№4 (с. 102)
Условие. №4 (с. 102)
скриншот условия
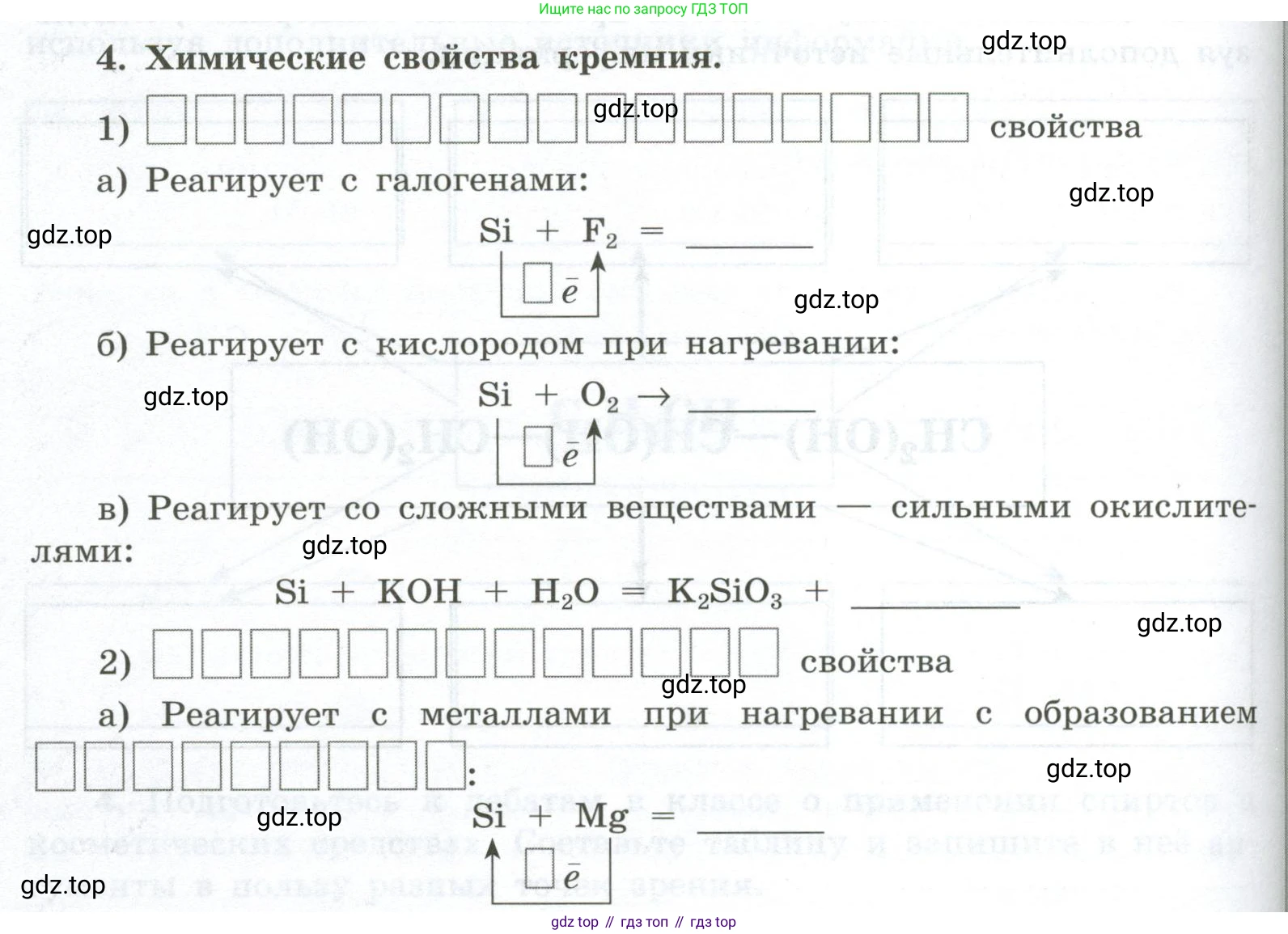

4. Химические свойства кремния.
1) ________ свойства
a) Реагирует с галогенами:
$Si + F_2 = \text{\_\_\_\_\_\_\_\_}$
$\uparrow \boxed{\bar{e}}$
б) Реагирует с кислородом при нагревании:
$Si + O_2 \to \text{\_\_\_\_\_\_\_\_}$
$\uparrow \boxed{\bar{e}}$
в) Реагирует со сложными веществами — сильными окислителями:
$Si + KOH + H_2O = K_2SiO_3 + \text{\_\_\_\_\_\_\_\_}$
2) ________ свойства
a) Реагирует с металлами при нагревании с образованием $\text{\_\_\_\_\_\_\_\_}$ :
$Si + Mg = \text{\_\_\_\_\_\_\_\_}$
$\uparrow \boxed{\bar{e}}$
б) С водородом прямо не взаимодействует, и $SiH_4$ — $\text{\_\_\_\_\_\_\_\_}$ получают косвенным путём:
$Mg_2Si + HCl = \text{\_\_\_\_\_\_\_\_}$
Решение. №4 (с. 102)
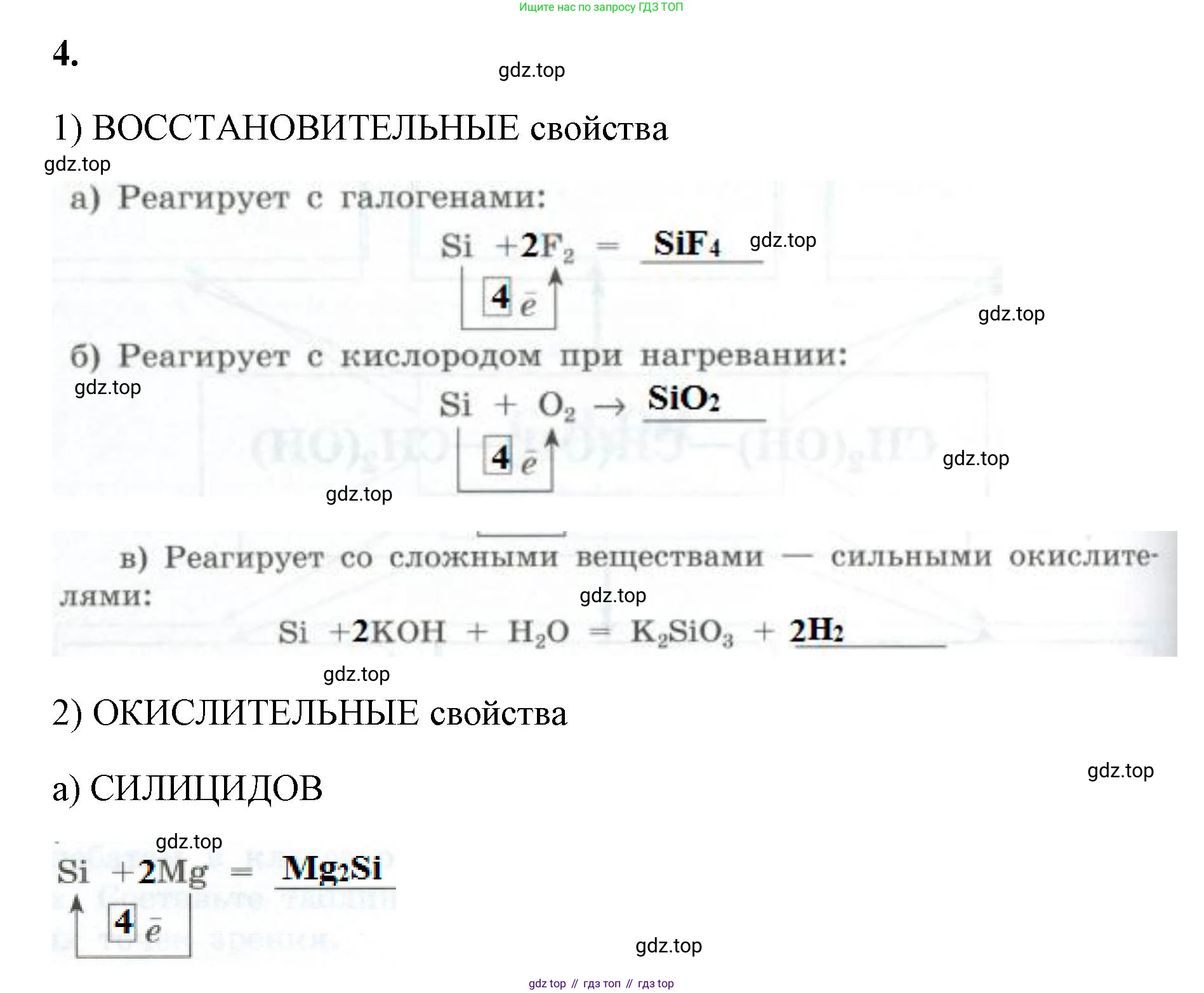

Решение 2. №4 (с. 102)
1) Восстановительные свойства
а) Реагирует с галогенами:
Решение: Кремний ($Si$) реагирует с фтором ($F_2$) с образованием тетрафторида кремния ($SiF_4$). В этой реакции кремний повышает свою степень окисления с 0 до +4, отдавая 4 электрона, и, следовательно, является восстановителем. Схема процесса окисления кремния: $Si^0 - 4\bar{e} \rightarrow Si^{+4}$. Уравнение реакции: $Si + 2F_2 = SiF_4$.
Ответ: Продукт реакции: $SiF_4$. Число электронов, отдаваемых атомом кремния: 4. Полное уравнение: $Si + 2F_2 = SiF_4$.
б) Реагирует с кислородом при нагревании:
Решение: При нагревании кремний ($Si$) взаимодействует с кислородом ($O_2$), в результате чего образуется оксид кремния(IV), также известный как диоксид кремния ($SiO_2$). Кремний выступает в роли восстановителя, отдавая 4 электрона и переходя в степень окисления +4. Схема процесса окисления: $Si^0 - 4\bar{e} \rightarrow Si^{+4}$. Уравнение реакции: $Si + O_2 \xrightarrow{t} SiO_2$.
Ответ: Продукт реакции: $SiO_2$. Число электронов, отдаваемых атомом кремния: 4. Полное уравнение: $Si + O_2 \xrightarrow{t} SiO_2$.
в) Реагирует со сложными веществами — сильными окислителями:
Решение: Кремний растворяется в горячих концентрированных растворах щелочей, например, в гидроксиде калия ($KOH$). Это окислительно-восстановительная реакция, в которой кремний окисляется до силикат-иона ($SiO_3^{2-}$), а водород из воды восстанавливается, выделяясь в виде газа ($H_2$). Электронный баланс: $Si^0 - 4\bar{e} \rightarrow Si^{+4}$ | 1 (восстановитель) $2H^{+1} + 2\bar{e} \rightarrow H_2^0$ | 2 (окислитель) Сбалансированное уравнение: $Si + 2KOH + H_2O = K_2SiO_3 + 2H_2$.
Ответ: Пропущенный продукт реакции: $2H_2$. Полное уравнение: $Si + 2KOH + H_2O = K_2SiO_3 + 2H_2\uparrow$.
2) Окислительные свойства
а) Реагирует с металлами при нагревании с образованием силицидов:
Решение: При взаимодействии с активными металлами, такими как магний ($Mg$), при нагревании кремний ($Si$) проявляет окислительные свойства. Он принимает 4 электрона, его степень окисления понижается с 0 до -4. Продукты таких реакций называются силицидами. В данном случае образуется силицид магния ($Mg_2Si$). Схема процесса восстановления кремния: $Si^0 + 4\bar{e} \rightarrow Si^{-4}$. Уравнение реакции: $2Mg + Si \xrightarrow{t} Mg_2Si$.
Ответ: Пропущенное слово: силицидов. Продукт реакции: $Mg_2Si$. Число электронов, принимаемых атомом кремния: 4. Полное уравнение: $2Mg + Si \xrightarrow{t} Mg_2Si$.
б) С водородом прямо не взаимодействует, и $SiH_4$ — силан — получают косвенным путём:
Решение: Водородное соединение кремния $SiH_4$ носит название силан. Силан не получают прямым синтезом из кремния и водорода. Один из способов его получения — реакция обмена между силицидами металлов и кислотами. При взаимодействии силицида магния ($Mg_2Si$) с соляной кислотой ($HCl$) образуются хлорид магния ($MgCl_2$) и силан ($SiH_4$). Уравнение реакции: $Mg_2Si + 4HCl = 2MgCl_2 + SiH_4\uparrow$.
Ответ: Пропущенное слово: силан. Продукты реакции: $2MgCl_2 + SiH_4$. Полное уравнение: $Mg_2Si + 4HCl = 2MgCl_2 + SiH_4$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 102 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 102), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















