Номер 2, страница 109 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §26. Получение неметаллов. Часть 2 - номер 2, страница 109.
№2 (с. 109)
Условие. №2 (с. 109)
скриншот условия

2. С помощью метода электронного баланса расставьте коэффициенты в схеме реакции получения хлора в лаборатории:
$HCl + KClO_3 \to \text{_______} + KCl + \text{_______}$
Решение. №2 (с. 109)
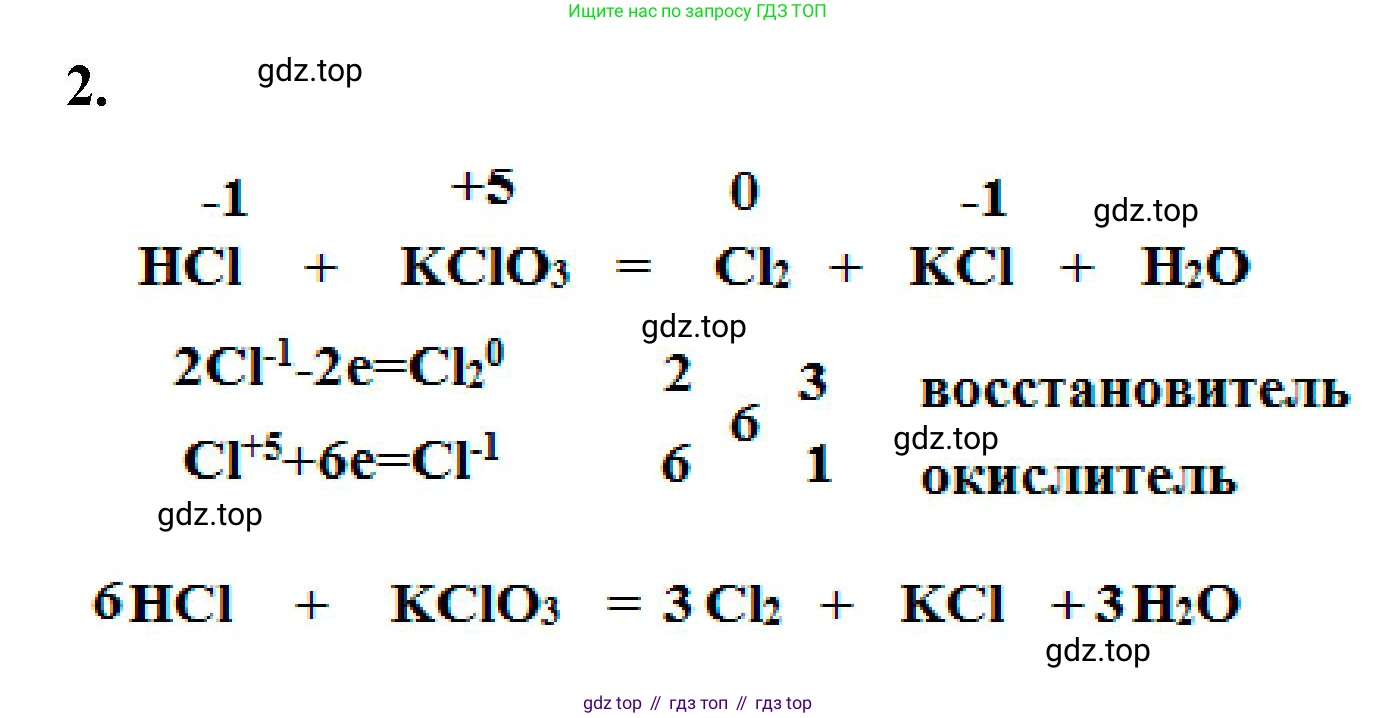
Решение 2. №2 (с. 109)
Чтобы расставить коэффициенты в уравнении реакции получения хлора, необходимо сначала определить все продукты реакции, а затем воспользоваться методом электронного баланса.
Решение
1. Реакция соляной кислоты ($HCl$) с хлоратом калия ($KClO_3$) является окислительно-восстановительной. Задание указывает на получение хлора ($Cl_2$). В продуктах также дан хлорид калия ($KCl$). Атомы водорода из кислоты и кислорода из хлората калия образуют воду ($H_2O$). Таким образом, полная схема реакции выглядит так:
$HCl + KClO_3 \rightarrow Cl_2 + KCl + H_2O$
2. Определим степени окисления элементов, которые их изменяют в ходе реакции:
$H\overset{+1}{Cl}\overset{-1}{} + K\overset{+1}{Cl}\overset{+5}{O_3}\overset{-2}{} \rightarrow \overset{0}{Cl_2} + K\overset{+1}{Cl}\overset{-1}{} + H_2\overset{+1}{O}\overset{-2}{}$
Степень окисления изменяет хлор:
- Хлор в соляной кислоте ($Cl^{-1}$) окисляется до простого вещества хлора ($Cl_2^{0}$). Соляная кислота является восстановителем.
- Хлор в хлорате калия ($Cl^{+5}$) восстанавливается до хлорида калия ($Cl^{-1}$). Хлорат калия является окислителем.
3. Составим уравнения полуреакций (электронный баланс):
Процесс окисления: $2Cl^{-1} - 2e^{-} \rightarrow Cl_2^{0}$
Процесс восстановления: $Cl^{+5} + 6e^{-} \rightarrow Cl^{-1}$
4. Найдём наименьшее общее кратное (НОК) для числа отданных (2) и принятых (6) электронов. НОК(2, 6) = 6. Чтобы уравнять число электронов, домножим полуреакцию окисления на 3, а полуреакцию восстановления на 1.
$2Cl^{-1} - 2e^{-} \rightarrow Cl_2^{0}$ $| \times 3$ (процесс окисления)
$Cl^{+5} + 6e^{-} \rightarrow Cl^{-1}$ $| \times 1$ (процесс восстановления)
Из баланса следует, что в реакции должно участвовать 6 атомов $Cl^{-1}$ и 1 атом $Cl^{+5}$. В результате образуется 3 молекулы $Cl_2$ и 1 ион $Cl^{-1}$.
5. Подставим полученные коэффициенты в уравнение реакции:
$6HCl + 1KClO_3 \rightarrow 3Cl_2 + 1KCl + H_2O$
6. Уравняем остальные элементы. В левой части уравнения 6 атомов водорода (из $6HCl$) и 3 атома кислорода (из $KClO_3$). Чтобы уравнять их в правой части, необходимо поставить коэффициент 3 перед молекулой воды ($H_2O$).
$6HCl + KClO_3 \rightarrow 3Cl_2 + KCl + 3H_2O$
7. Проверим баланс всех атомов:
H: слева 6, справа 3 × 2 = 6.
Cl: слева 6 + 1 = 7, справа 3 × 2 + 1 = 7.
K: слева 1, справа 1.
O: слева 3, справа 3.
Все атомы уравнены, коэффициенты расставлены верно. Пропущенными веществами в схеме были хлор ($Cl_2$) и вода ($H_2O$).
Ответ: $6HCl + KClO_3 \rightarrow 3Cl_2 + KCl + 3H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 109 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 109), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















