Номер 3, страница 141 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава IV. Металлы и их соединения. §36. Металлы в природе. Понятие о металлургии. Часть 2 - номер 3, страница 141.
№3 (с. 141)
Условие. №3 (с. 141)
скриншот условия

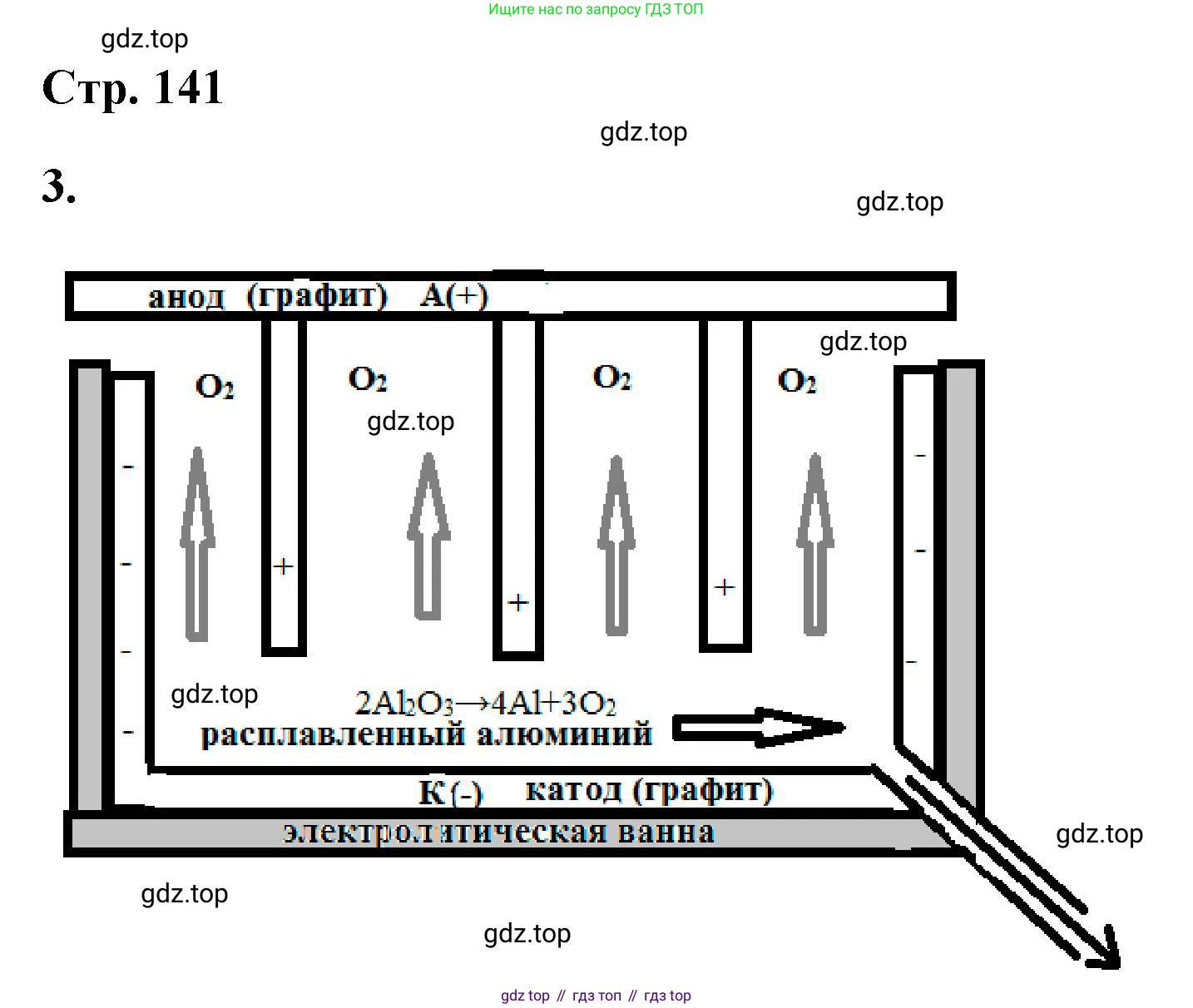
3. Нарисуйте схему электролизной ванны для получения алюминия.
Решение. №3 (с. 141)
Решение 2. №3 (с. 141)
3.
Решение
Промышленное получение алюминия осуществляется электролизом раствора оксида алюминия (глинозема $Al_2O_3$) в расплавленном криолите ($Na_3AlF_6$) при температуре около 950 °C. Этот процесс называется процессом Холла-Эру. Электролизная ванна (электролизер) для этого процесса имеет следующее устройство.
Схема и устройство электролизной ванны:
Поскольку нарисовать схему в текстовом формате невозможно, приведем ее подробное словесное описание, которое соответствует стандартной схеме.
Электролизер представляет собой большую стальную ванну прямоугольной формы. Основные элементы:
1. Катод: Внутренняя поверхность стальной ванны выложена (футерована) угольными (графитовыми) блоками. Эта угольная футеровка служит катодом (отрицательным электродом). К стальному корпусу, соединенному с футеровкой, подключается отрицательный полюс источника постоянного тока. На дне ванны скапливается слой расплавленного жидкого алюминия, который также является частью катода и обеспечивает хороший электрический контакт.
2. Анод: Сверху в ванну на специальных держателях погружены массивные угольные блоки (предварительно обожженные или самообжигающиеся). Эти блоки являются анодом (положительным электродом). К ним подводится положительный полюс источника тока. В ходе электролиза аноды окисляются и постепенно расходуются («сгорают»), поэтому их необходимо периодически заменять или наращивать.
3. Электролит: Пространство между анодами и катодом заполнено расплавом. Электролит состоит из криолита ($Na_3AlF_6$) с растворенным в нем глиноземом ($Al_2O_3$). Чистый глинозем имеет очень высокую температуру плавления (более 2000 °C), а криолит выступает в роли растворителя, снижая рабочую температуру процесса до ~950 °C. Это делает процесс значительно более энергоэффективным. Поверхность расплава покрыта коркой из застывшего глинозема, которая уменьшает теплопотери.
4. Продукты реакции: В результате электролиза на дне ванны под слоем электролита собирается жидкий алюминий. Его плотность (~2,3 г/см³) выше плотности электролита (~2,1 г/см³), что позволяет ему оседать на дне. Периодически алюминий откачивают из ванны с помощью вакуумного ковша. Газообразные продукты (в основном $CO_2$) отводятся из-под анодов системой газоотвода.
Химические процессы в электролизере:
При пропускании постоянного электрического тока через расплав происходят следующие реакции:
1. Диссоциация оксида алюминия в расплаве на ионы: $Al_2O_3 \rightarrow 2Al^{3+} + 3O^{2-}$
2. На катоде (угольная футеровка и слой жидкого Al) происходит восстановление ионов алюминия:
$Al^{3+} + 3e^- \rightarrow Al^0(l)$
3. На аноде (угольные блоки) происходит окисление ионов кислорода:
$2O^{2-} - 4e^- \rightarrow O_2(g)$
Выделившийся на раскаленном угольном аноде кислород немедленно реагирует с углеродом анода:
$C(s) + O_2(g) \rightarrow CO_2(g)$
4. Суммарное уравнение всего процесса, учитывающее расход анода:
$2Al_2O_3(раствор) + 3C(s) \rightarrow 4Al(l) + 3CO_2(g)$
Ответ: Схема электролизной ванны для получения алюминия включает стальной кожух, внутренняя поверхность которого покрыта угольными блоками, служащими катодом. Сверху в ванну погружены угольные аноды. Пространство между электродами заполнено расплавом оксида алюминия ($Al_2O_3$) в криолите ($Na_3AlF_6$). При электролизе на катоде (дне ванны) образуется и скапливается жидкий алюминий, а на угольных анодах выделяется кислород, который реагирует с углеродом анодов, образуя углекислый газ ($CO_2$), что приводит к постепенному расходу анодов.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 141 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 141), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















