Практическая работа 6, страница 130 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 6. Углерод и кремний. Параграф 36. Практическая работа 6. Получение оксида углерода (V) и изучение его свойств. Распознавание карбонатов - страница 130.
Практическая работа 6 (с. 130)
Условие. Практическая работа 6 (с. 130)
скриншот условия

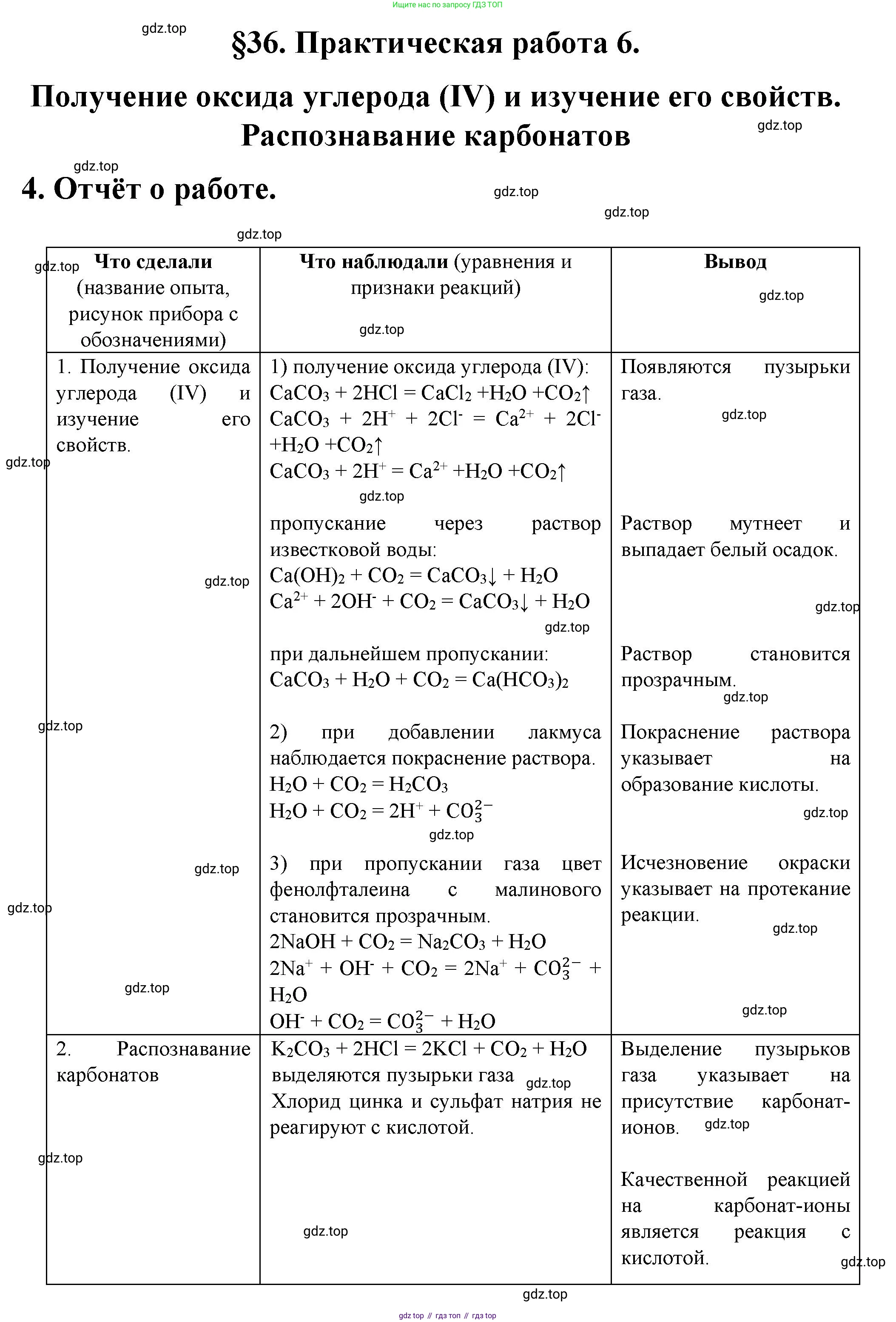
1. Получение оксида углерода(IV) и изучение его свойств
1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2–3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду.
● Что происходит, если на мел (мрамор) действуют соляной кислотой?
● Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется?
2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2–3 мл дистиллированной воды и пропустите через неё выделяющийся газ. Через несколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете?
3) В пробирку налейте 2–3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете?
● Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
2. Распознавание карбонатов
В трёх пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке.
● Сделайте вывод, что является качественной реакцией на $CO_3^{2-}$-ионы. Напишите соответствующее уравнение реакции.
3. Отчёт о работе оформите в виде таблицы (см. § 16).
Решение. Практическая работа 6 (с. 130)
Решение 2. Практическая работа 6 (с. 130)
1. Получение оксида углерода(IV) и изучение его свойств
1) Взаимодействие мела с кислотой и пропускание газа через известковую воду
Что происходит, если на мел (мрамор) действуют соляной кислотой?
Мел и мрамор являются природными формами карбоната кальция ($CaCO_3$). При добавлении к ним разбавленной соляной кислоты ($HCl$) происходит бурная химическая реакция, сопровождающаяся шипением и выделением пузырьков газа. Твёрдое вещество при этом растворяется. Выделяющийся газ — это оксид углерода(IV) или углекислый газ ($CO_2$), он не имеет цвета и запаха. Реакция описывается уравнением:
$CaCO_3(тв) + 2HCl(р-р) \rightarrow CaCl_2(р-р) + H_2O(ж) + CO_2(г)\uparrow$
Ответ: Происходит реакция с выделением углекислого газа и растворением карбоната кальция.
Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется?
Известковая вода — это насыщенный водный раствор гидроксида кальция ($Ca(OH)_2$).
Сначала углекислый газ, проходя через раствор, реагирует с гидроксидом кальция с образованием нерастворимого в воде белого осадка — карбоната кальция ($CaCO_3$). Именно этот осадок вызывает помутнение раствора.
$CO_2(г) + Ca(OH)_2(р-р) \rightarrow CaCO_3(тв)\downarrow + H_2O(ж)$
При дальнейшем пропускании избытка углекислого газа через раствор, образовавшийся осадок карбоната кальция вступает в реакцию с водой и углекислым газом. В результате образуется гидрокарбонат кальция $Ca(HCO_3)_2$, который хорошо растворим в воде. Осадок растворяется, и мутный раствор снова становится прозрачным.
$CaCO_3(тв) + H_2O(ж) + CO_2(г) \rightarrow Ca(HCO_3)_2(р-р)$
Ответ: Помутнение вызвано образованием нерастворимого $CaCO_3$, а последующее растворение — его переходом в растворимый $Ca(HCO_3)_2$ в избытке $CO_2$.
2) Взаимодействие углекислого газа с водой
При пропускании углекислого газа через дистиллированную воду образуется слабая угольная кислота ($H_2CO_3$), которая создаёт в растворе кислую среду.
$CO_2(г) + H_2O(ж) \rightleftharpoons H_2CO_3(р-р)$
Индикатор лакмус в кислой среде меняет свой синий цвет на красный. Поэтому при добавлении нескольких капель синего лакмуса в воду, через которую пропускали $CO_2$, наблюдается изменение окраски на красную (или розовую).
Ответ: Синий лакмус становится красным, так как образуется угольная кислота.
3) Взаимодействие углекислого газа с раствором гидроксида натрия
Раствор гидроксида натрия ($NaOH$) является щёлочью. Индикатор фенолфталеин в щелочной среде имеет малиновую окраску. Углекислый газ ($CO_2$) — это кислотный оксид, который реагирует со щелочами (происходит реакция нейтрализации).
$CO_2(г) + 2NaOH(р-р) \rightarrow Na_2CO_3(р-р) + H_2O(ж)$
По мере пропускания газа щёлочь расходуется, pH раствора снижается. Когда среда становится нейтральной или слабощелочной (pH < 8.2), фенолфталеин обесцвечивается. Поэтому наблюдается исчезновение малиновой окраски раствора.
Ответ: Малиновая окраска раствора, созданная фенолфталеином в щёлочи, исчезает, так как углекислый газ нейтрализует щёлочь.
Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
1. Получение оксида углерода(IV):
Молекулярное: $CaCO_3(тв) + 2HCl \rightarrow CaCl_2 + H_2O + CO_2\uparrow$
Полное ионное: $CaCO_3(тв) + 2H^+ + 2Cl^- \rightarrow Ca^{2+} + 2Cl^- + H_2O + CO_2\uparrow$
Сокращённое ионное: $CaCO_3(тв) + 2H^+ \rightarrow Ca^{2+} + H_2O + CO_2\uparrow$
2. Реакция $CO_2$ с известковой водой (помутнение):
Молекулярное: $CO_2 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + H_2O$
Полное ионное: $CO_2 + Ca^{2+} + 2OH^- \rightarrow CaCO_3\downarrow + H_2O$
Сокращённое ионное: $CO_2 + Ca^{2+} + 2OH^- \rightarrow CaCO_3\downarrow + H_2O$
3. Растворение осадка $CaCO_3$ в избытке $CO_2$:
Молекулярное: $CaCO_3 + H_2O + CO_2 \rightarrow Ca(HCO_3)_2$
Полное ионное: $CaCO_3(тв) + H_2O + CO_2 \rightarrow Ca^{2+} + 2HCO_3^-$
Сокращённое ионное: $CaCO_3(тв) + H_2O + CO_2 \rightarrow Ca^{2+} + 2HCO_3^-$
4. Реакция $CO_2$ с водой:
Молекулярное: $CO_2 + H_2O \rightleftharpoons H_2CO_3$
(Для этой обратимой реакции с образованием слабой кислоты ионные уравнения обычно не записывают в школьном курсе).
5. Реакция $CO_2$ с гидроксидом натрия:
Молекулярное: $CO_2 + 2NaOH \rightarrow Na_2CO_3 + H_2O$
Полное ионное: $CO_2 + 2Na^+ + 2OH^- \rightarrow 2Na^+ + CO_3^{2-} + H_2O$
Сокращённое ионное: $CO_2 + 2OH^- \rightarrow CO_3^{2-} + H_2O$
Ответ: Уравнения реакций приведены выше.
2. Распознавание карбонатов
Для определения, какое вещество (сульфат натрия $Na_2SO_4$, хлорид цинка $ZnCl_2$ или карбонат калия $K_2CO_3$) находится в каждой из трёх пробирок, можно провести следующий эксперимент.
Решение
Во все три пробирки с растворами исследуемых веществ добавляем раствор сильной кислоты, например, соляной ($HCl$). В той пробирке, где наблюдается бурное выделение газа (шипение), находится карбонат калия.
$K_2CO_3 + 2HCl \rightarrow 2KCl + H_2O + CO_2\uparrow$
В двух других пробирках (с $Na_2SO_4$ и $ZnCl_2$) видимых изменений не произойдёт.
Теперь необходимо различить оставшиеся два вещества. Для этого в пробирки с сульфатом натрия и хлоридом цинка добавляем раствор щёлочи, например, гидроксида натрия ($NaOH$). В пробирке с хлоридом цинка выпадет белый студенистый осадок гидроксида цинка.
$ZnCl_2 + 2NaOH \rightarrow Zn(OH)_2\downarrow + 2NaCl$
В пробирке с сульфатом натрия реакция не пойдёт, видимых изменений не будет.
- Таким образом, третья, оставшаяся пробирка, содержит сульфат натрия.
Ответ: Вещества распознаются последовательным действием кислоты (выделение газа с $K_2CO_3$) и щёлочи (выпадение осадка с $ZnCl_2$).
Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
Качественной реакцией на карбонат-ион ($CO_3^{2-}$) является его взаимодействие с ионами водорода ($H^+$) из сильных кислот. В результате реакции выделяется углекислый газ ($CO_2$), что наблюдается как вскипание раствора. Для дополнительного подтверждения выделяющийся газ пропускают через известковую воду ($Ca(OH)_2$), которая мутнеет.
Уравнение реакции в сокращённом ионном виде:
$CO_3^{2-}(р-р) + 2H^+(р-р) \rightarrow H_2O(ж) + CO_2(г)\uparrow$
Ответ: Качественная реакция на карбонат-ион — взаимодействие с сильной кислотой с выделением углекислого газа.
3. Отчёт о работе оформите в виде таблицы (см. § 16)
Поскольку содержание § 16 неизвестно, ниже представлен примерный вид таблицы для оформления отчёта по опытам из пункта 1.
| Что делали (Действия) | Что наблюдали (Наблюдения) | Выводы и уравнения реакций |
| 1. К кусочкам мела добавили раствор соляной кислоты. Выделяющийся газ пропустили через известковую воду. | Бурное выделение газа, растворение мела. При пропускании газа через известковую воду она сначала помутнела, а затем стала прозрачной. | Мел ($CaCO_3$) реагирует с кислотой с выделением $CO_2$. $CO_2$ с $Ca(OH)_2$ даёт осадок $CaCO_3$, который в избытке $CO_2$ растворяется. $CaCO_3 + 2H^+ \rightarrow Ca^{2+} + H_2O + CO_2\uparrow$ $CO_2 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + H_2O$ $CaCO_3 + H_2O + CO_2 \rightarrow Ca(HCO_3)_2$ |
| 2. Пропустили $CO_2$ через дистиллированную воду и добавили синий лакмус. | Окраска лакмуса изменилась с синей на красную. | $CO_2$ образует с водой слабую угольную кислоту, создающую кислую среду. $CO_2 + H_2O \rightleftharpoons H_2CO_3$ |
| 3. Пропустили $CO_2$ через раствор гидроксида натрия с фенолфталеином. | Малиновая окраска раствора исчезла. | $CO_2$ (кислотный оксид) нейтрализует щёлочь $NaOH$, в результате чего индикатор обесцвечивается. $CO_2 + 2OH^- \rightarrow CO_3^{2-} + H_2O$ |
Ответ: Отчёт о проделанной работе следует оформить в виде таблицы, отражающей действия, наблюдения и выводы с уравнениями реакций для каждого этапа эксперимента.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Практическая работа 6 расположенного на странице 130 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Практическая работа 6 (с. 130), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















