Номер 3, страница 163 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 7. Металлы. Параграф 45. Важнейшие соединения кальция. Жёсткость воды. Подумай, ответь, выполни... - номер 3, страница 163.
№3 (с. 163)
Условие. №3 (с. 163)
скриншот условия

3. Каковы основные способы устранения жёсткости воды? Напишите уравнения соответствующих реакций.
Решение. №3 (с. 163)

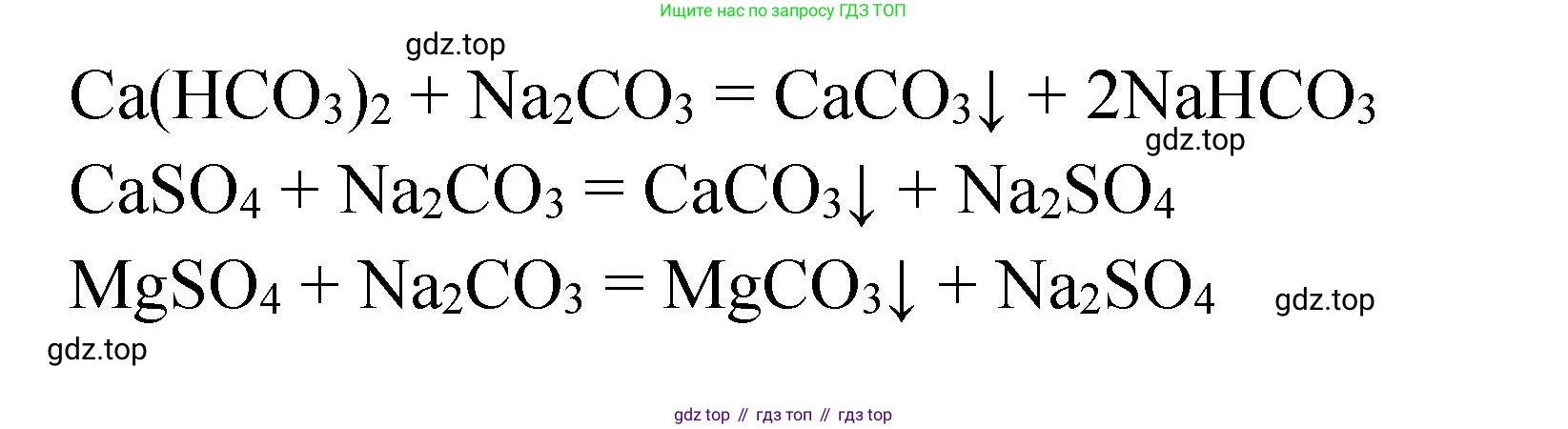
Решение 2. №3 (с. 163)
Жёсткость воды — это свойство, обусловленное наличием в ней растворённых солей кальция ($Ca^{2+}$) и магния ($Mg^{2+}$). Различают два вида жёсткости:
- Временная (карбонатная) жёсткость, вызванная гидрокарбонатами $Ca(HCO_3)_2$ и $Mg(HCO_3)_2$. Её можно устранить кипячением.
- Постоянная (некарбонатная) жёсткость, вызванная сульфатами, хлоридами и другими солями кальция и магния (например, $CaSO_4$, $MgCl_2$). Кипячением не устраняется.
Общая жёсткость является суммой временной и постоянной. Для умягчения воды (устранения жёсткости) применяют следующие основные способы.
1. Термический способ (кипячение)
Этот способ эффективен только для устранения временной жёсткости. При нагревании растворимые гидрокарбонаты кальция и магния разлагаются, образуя нерастворимые соединения (накипь), которые выпадают в осадок.
Уравнения соответствующих реакций:
При кипячении гидрокарбонат кальция превращается в нерастворимый карбонат кальция:
$Ca(HCO_3)_2 \xrightarrow{t^\circ} CaCO_3\downarrow + H_2O + CO_2\uparrow$
Гидрокарбонат магния при кипячении образует нерастворимый гидроксид магния, так как образующийся карбонат магния гидролизуется в горячей воде:
$Mg(HCO_3)_2 \xrightarrow{t^\circ} Mg(OH)_2\downarrow + 2CO_2\uparrow$
2. Химические (реагентные) способы
Суть этих методов заключается в добавлении в воду специальных реагентов, которые связывают ионы $Ca^{2+}$ и $Mg^{2+}$ в нерастворимые соединения, удаляемые затем фильтрованием или отстаиванием.
а) Известковый способ (устранение временной жёсткости)
Добавление гашёной извести (гидроксида кальция $Ca(OH)_2$) позволяет осадить ионы кальция и магния из гидрокарбонатов.
Уравнения реакций:
$Ca(HCO_3)_2 + Ca(OH)_2 \rightarrow 2CaCO_3\downarrow + 2H_2O$
$Mg(HCO_3)_2 + 2Ca(OH)_2 \rightarrow Mg(OH)_2\downarrow + 2CaCO_3\downarrow + 2H_2O$
б) Содовый способ (устранение постоянной жёсткости)
Добавление кальцинированной соды (карбоната натрия $Na_2CO_3$) позволяет устранить постоянную жёсткость, переводя растворимые соли кальция и магния в нерастворимые карбонаты.
Уравнения реакций:
$CaSO_4 + Na_2CO_3 \rightarrow CaCO_3\downarrow + Na_2SO_4$
$MgCl_2 + Na_2CO_3 \rightarrow MgCO_3\downarrow + 2NaCl$
Для одновременного удаления временной и постоянной жёсткости используют содово-известковый метод.
в) Фосфатный способ (устранение общей жёсткости)
Использование фосфатов, например ортофосфата натрия $Na_3PO_4$ или полифосфатов, является очень эффективным методом, так как фосфаты кальция и магния обладают крайне низкой растворимостью.
Уравнения реакций в ионном виде:
$3Ca^{2+} + 2PO_4^{3-} \rightarrow Ca_3(PO_4)_2\downarrow$
$3Mg^{2+} + 2PO_4^{3-} \rightarrow Mg_3(PO_4)_2\downarrow$
3. Ионный обмен
Это современный и широко распространенный метод. Воду пропускают через колонку с ионообменной смолой (ионитом). Иониты — это твёрдые нерастворимые вещества, способные обменивать свои ионы на ионы из раствора. Для умягчения воды используют катиониты в натриевой форме ($Na-катионит$).
Уравнения реакций (где R — матрица ионита):
Ионы $Ca^{2+}$ и $Mg^{2+}$ из воды замещают ионы $Na^{+}$ в ионите:
$Ca^{2+} + 2NaR \rightarrow CaR_2 + 2Na^{+}$
$Mg^{2+} + 2NaR \rightarrow MgR_2 + 2Na^{+}$
В результате вода обогащается ионами натрия, а ионы жёсткости остаются в фильтре. Истощённый ионит регенерируют, промывая его концентрированным раствором поваренной соли ($NaCl$).
4. Физические (мембранные) методы
К ним относятся обратный осмос и дистилляция. В первом случае воду под давлением продавливают через полупроницаемую мембрану, которая пропускает молекулы воды, но задерживает ионы солей. Во втором случае воду испаряют, а затем конденсируют пар, получая чистую воду без солей. Эти методы позволяют получить воду высокой степени очистки, но являются более дорогостоящими и/или энергозатратными. Химических уравнений для этих процессов нет.
Ответ:
- Термический (кипячение): устраняет временную жёсткость. Уравнение реакции: $Ca(HCO_3)_2 \xrightarrow{t^\circ} CaCO_3\downarrow + H_2O + CO_2\uparrow$.
- Химический (реагентный): добавление реагентов (извести, соды, фосфатов) для осаждения ионов $Ca^{2+}$ и $Mg^{2+}$. Уравнения реакций: $Ca(HCO_3)_2 + Ca(OH)_2 \rightarrow 2CaCO_3\downarrow + 2H_2O$ (устранение временной жёсткости); $CaSO_4 + Na_2CO_3 \rightarrow CaCO_3\downarrow + Na_2SO_4$ (устранение постоянной жёсткости).
- Ионообменный: фильтрация воды через ионообменные смолы, которые заменяют ионы $Ca^{2+}$ и $Mg^{2+}$ на ионы $Na^{+}$. Уравнение реакции: $Ca^{2+} + 2NaR \rightarrow CaR_2 + 2Na^{+}$ (где R - матрица ионита).
- Физические методы: обратный осмос и дистилляция, которые физически отделяют воду от растворённых солей.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 163 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 163), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















