Номер 5, страница 39 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 8. Озон — аллотропная модификация кислорода - номер 5, страница 39.
№5 (с. 39)
Условие. №5 (с. 39)
скриншот условия

5. Смесь двух простых газообразных веществ объёмом 11,2 л (н. у.) пропустили через избыток подкисленного раствора иодида калия. При этом образовалось 2,54 г иода, а газ после реакции содержит только одно из исходных веществ, и объём его 11,2 л (н. у.). Что представляет собой исходная смесь? Напишите уравнение реакции.
Решение. №5 (с. 39)

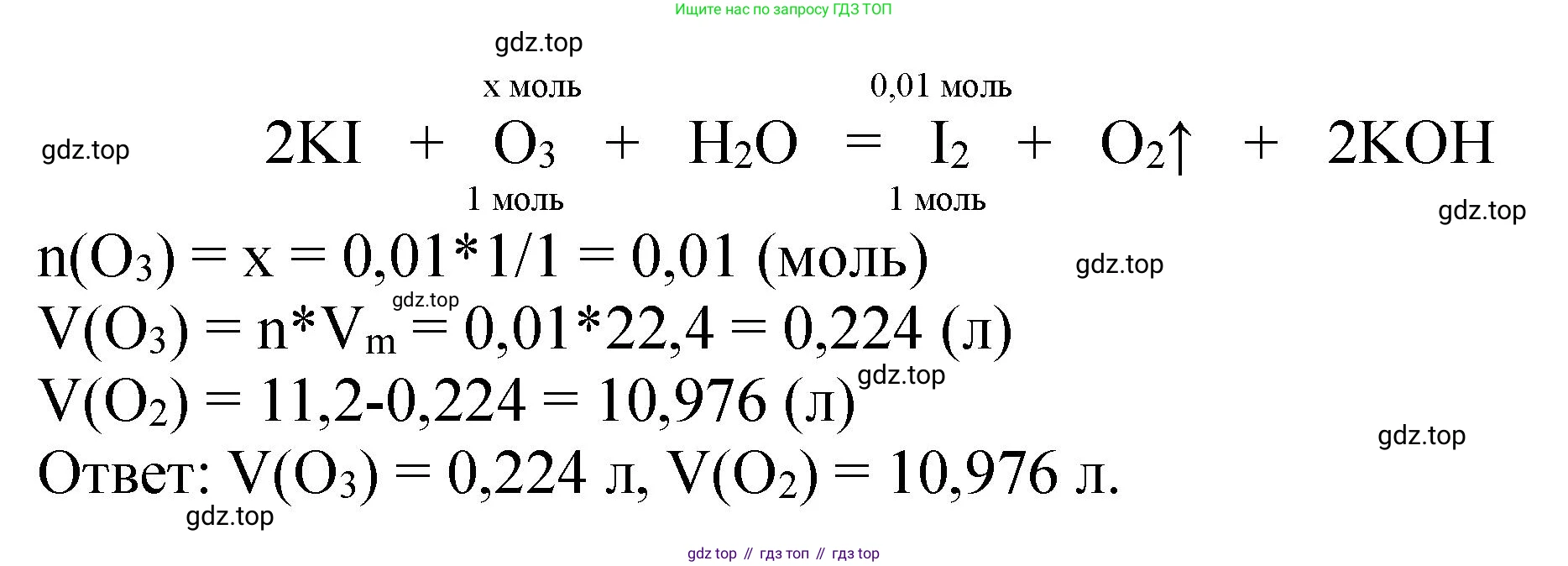
Решение 2. №5 (с. 39)
Дано:
$V_{смеси} = 11,2 \ л$ (н.у.)
$m(I_2) = 2,54 \ г$
$V_{конечный} = 11,2 \ л$ (н.у.)
Исходные вещества — два простых газообразных вещества.
Газ после реакции — одно из исходных веществ.
Найти:
Состав исходной смеси, уравнение реакции.
Решение:
Смесь двух простых газообразных веществ пропустили через подкисленный раствор иодида калия, в результате чего выделился иод. Это указывает на то, что один из газов в смеси является окислителем, способным окислить иодид-ионы ($I^−$) до свободного иода ($I_2$). Второй газ в данных условиях в реакцию не вступает.
Ключевым условием задачи является то, что объем газовой смеси не изменился после реакции ($V_{начальный} = V_{конечный} = 11,2 \ л$), и конечный газ представляет собой одно из исходных веществ. Обозначим реагирующий газ как А, а инертный — как Б.
$V_{начальный} = V(А) + V(Б) = 11,2 \ л$.
Если бы газ А реагировал без образования газообразных продуктов, то конечный объем был бы равен $V(Б)$, что меньше 11,2 л. Если бы в реакции образовывался новый газ В, то конечная смесь состояла бы из Б и В, что противоречит условию.
Следовательно, в ходе реакции газ А должен был превратиться в газ Б.
$aA(г) \rightarrow bБ(г)$
Объем газа после реакции будет состоять из первоначального объема газа Б и объема газа Б, образовавшегося из А:
$V_{конечный} = V(Б) + V_{прод}(Б) = 11,2 \ л$.
Так как $V(А) + V(Б) = 11,2 \ л$, то из сравнения следует, что $V_{прод}(Б) = V(А)$.
Согласно закону Авогадро, это означает, что из одного моля газа А образуется один моль газа Б.
Единственной парой простых веществ, которые являются газами при н.у. и удовлетворяют этому условию, являются озон ($O_3$) и кислород ($O_2$). Озон — сильный окислитель и реагирует с иодидом калия, превращаясь при этом в кислород:
В подкисленной среде (например, серной кислотой) реакция выглядит так:
$O_3 + 2KI + H_2SO_4 \rightarrow I_2 + O_2 + K_2SO_4 + H_2O$
Сокращенное ионное уравнение:
$O_3 + 2I^- + 2H^+ \rightarrow I_2 + O_2 + H_2O$
Из уравнения видно, что из 1 моль $O_3$ образуется 1 моль $O_2$, то есть объем газа в ходе реакции сохраняется. Кислород ($O_2$) при этом является инертным компонентом смеси. Таким образом, исходная смесь состояла из озона и кислорода.
Найдем количество вещества образовавшегося иода. Молярная масса иода $M(I_2) = 2 \cdot 127 = 254 \ г/моль$.
$n(I_2) = \frac{m(I_2)}{M(I_2)} = \frac{2,54 \ г}{254 \ г/моль} = 0,01 \ моль$.
По уравнению реакции, количество моль прореагировавшего озона равно количеству моль образовавшегося иода:
$n(O_3) = n(I_2) = 0,01 \ моль$.
Найдем объем озона в исходной смеси (при н.у., молярный объем $V_m = 22,4 \ л/моль$):
$V(O_3) = n(O_3) \cdot V_m = 0,01 \ моль \cdot 22,4 \ л/моль = 0,224 \ л$.
Тогда объем кислорода в исходной смеси:
$V(O_2) = V_{смеси} - V(O_3) = 11,2 \ л - 0,224 \ л = 10,976 \ л$.
Ответ: Исходная смесь представляет собой смесь озона ($O_3$) и кислорода ($O_2$). Объем озона в смеси — 0,224 л, объем кислорода — 10,976 л. Уравнение реакции: $O_3 + 2KI + H_2SO_4 \rightarrow I_2 + O_2 + K_2SO_4 + H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 5 расположенного на странице 39 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 39), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















