Номер 1, страница 308 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 6. Теоретическое описание химических реакций. Параграф 65. Принцип Ле Шателье - номер 1, страница 308.
№1 (с. 308)
Условие. №1 (с. 308)
скриншот условия

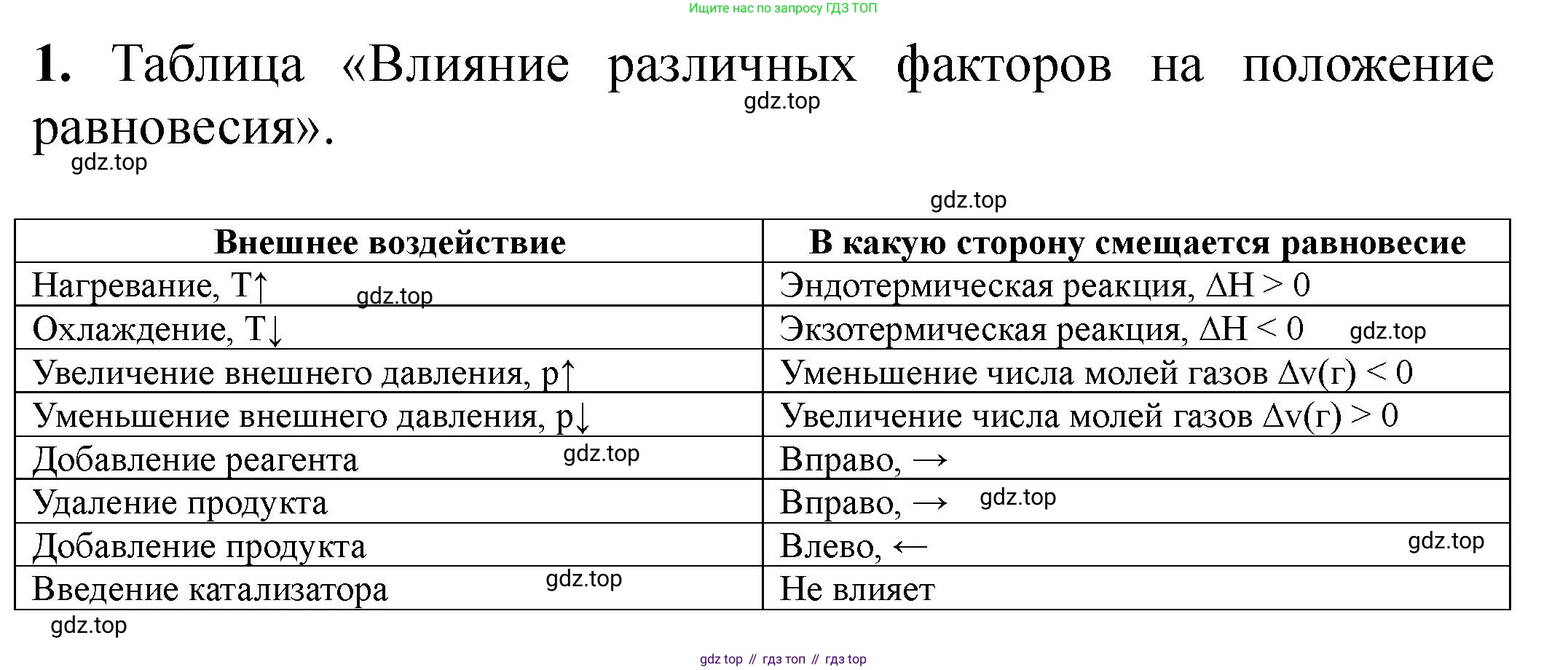
1. Заполните пропуски в таблице, обобщающей влияние различных факторов на положение равновесия эндотермической реакции, протекающей с увеличением числа молекул газов.
Влияние различных факторов на положение равновесия
Внешнее воздействие | В какую сторону смещается равновесие
| Эндотермическая реакция, $\Delta H > 0$
Охлаждение, $T \downarrow$ |
Увеличение внешнего давления, $p \uparrow$ |
| Увеличение числа молей газов $\Delta v(r) > 0$
| Влево, $\leftarrow$
Добавление реагента |
Удаление продукта |
Удаление реагента |
Введение катализатора |
Решение. №1 (с. 308)
Решение 2. №1 (с. 308)
Для решения данной задачи воспользуемся принципом Ле Шателье, согласно которому, если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию веществ), то равновесие сместится в таком направлении, чтобы ослабить это воздействие. Реакция является эндотермической ($\Delta H > 0$) и протекает с увеличением числа молекул газов ($\Delta\nu(г) > 0$).
Охлаждение, $T\downarrow$При охлаждении системы равновесие смещается в сторону экзотермической реакции (с выделением теплоты), чтобы скомпенсировать понижение температуры. Так как прямая реакция эндотермическая ($\Delta H > 0$), обратная реакция является экзотермической. Следовательно, равновесие сместится влево, в сторону исходных веществ.
Ответ: Влево, $\leftarrow$.
Увеличение внешнего давления, $p\uparrow$При увеличении внешнего давления равновесие смещается в сторону уменьшения общего числа молей газообразных веществ, чтобы скомпенсировать рост давления. По условию, прямая реакция идет с увеличением числа молей газов ($\Delta\nu(г) > 0$), значит, обратная реакция протекает с их уменьшением. Таким образом, равновесие сместится влево.
Ответ: Влево, $\leftarrow$.
Внешнее воздействие, приводящее к смещению в сторону увеличения числа молей газов ($\Delta\nu(г) > 0$)Смещение равновесия в сторону увеличения числа молей газов для данной реакции означает смещение вправо ($\rightarrow$). Для эндотермической реакции ($\Delta H > 0$) нагревание ($T\uparrow$) смещает равновесие в сторону прямой реакции. Также, для реакции с $\Delta\nu(г) > 0$ уменьшение давления ($p\downarrow$) смещает равновесие вправо. Любой из этих факторов может быть указан в качестве ответа.
Ответ: Нагревание ($T\uparrow$) или уменьшение давления ($p\downarrow$).
Внешнее воздействие, приводящее к смещению равновесия влево ($\leftarrow$)Смещение равновесия влево, в сторону исходных веществ, может быть вызвано несколькими факторами: охлаждением, увеличением давления, добавлением продуктов реакции или удалением реагентов. Поскольку другие факторы уже рассмотрены в таблице или будут рассмотрены ниже, в эту ячейку логично вписать добавление продукта.
Ответ: Добавление продукта.
Добавление реагентаПри увеличении концентрации одного из реагентов система стремится его израсходовать, что приводит к смещению равновесия в сторону прямой реакции, то есть вправо.
Ответ: Вправо, $\rightarrow$.
Удаление продуктаПри уменьшении концентрации одного из продуктов система стремится его восполнить, что приводит к смещению равновесия в сторону прямой реакции, то есть вправо.
Ответ: Вправо, $\rightarrow$.
Удаление реагентаПри уменьшении концентрации одного из реагентов система стремится его восполнить, что приводит к смещению равновесия в сторону обратной реакции, то есть влево.
Ответ: Влево, $\leftarrow$.
Введение катализатораКатализатор в равной степени ускоряет как прямую, так и обратную реакции, не влияя на положение химического равновесия. Он лишь ускоряет время его достижения.
Ответ: Не смещается.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1 расположенного на странице 308 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 308), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.
















