Номер 3, страница 34 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава II. Строение вещества. Параграф 7. Основные виды химической связи. Ионная и ковалентная связь. Подумайте, ответьте, выполните... - номер 3, страница 34.
№3 (с. 34)
Условие. №3 (с. 34)
скриншот условия

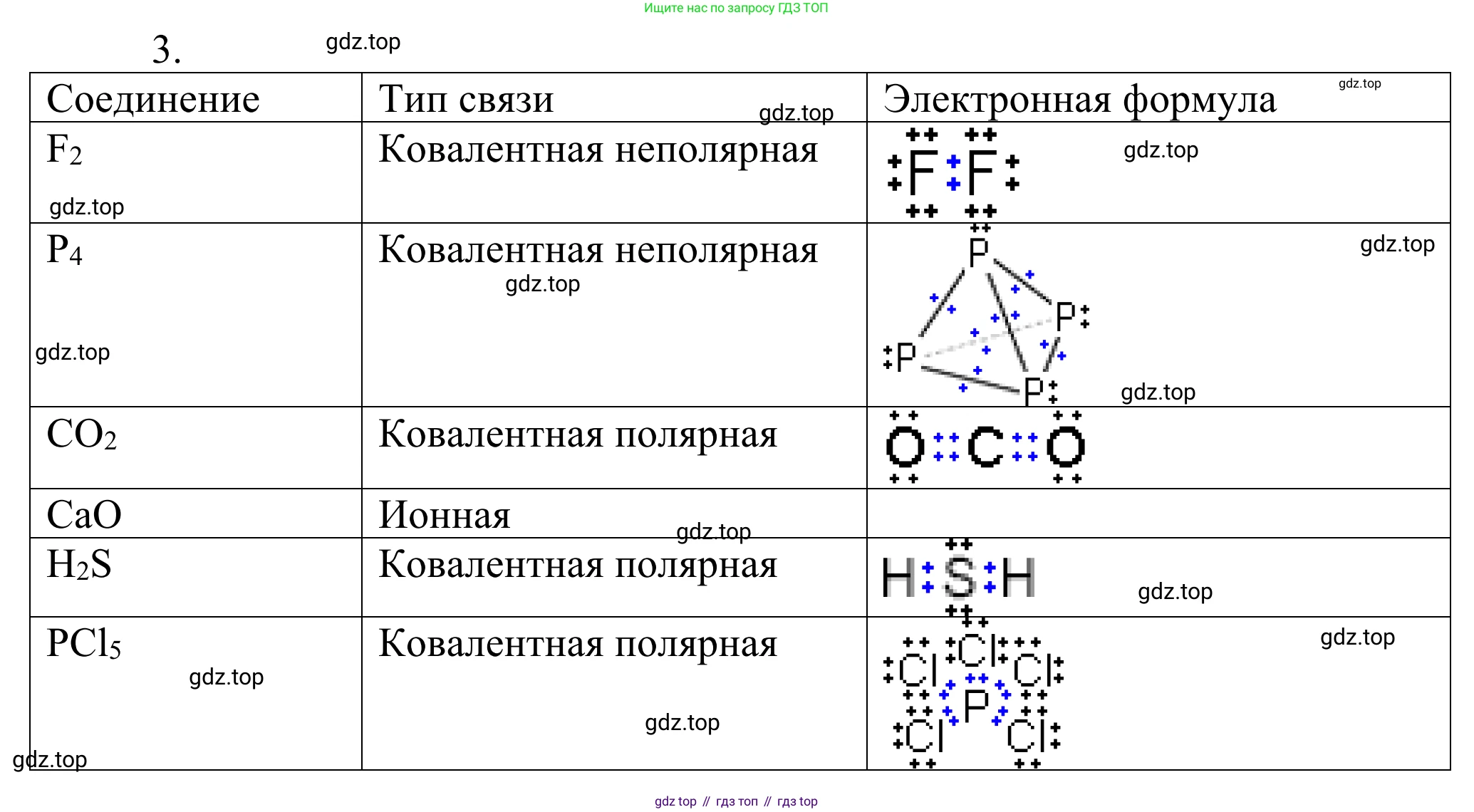
3. Определите вид химической связи в следующих веществах: $F_2$, $P_4$, $CO_2$, $CaO$, $H_2S$, $PCl_5$. Для ковалентных соединений составьте электронные формулы.
Решение. №3 (с. 34)
Решение 2. №3 (с. 34)
$F_2$
Химическая связь в молекуле фтора $F_2$ образована двумя одинаковыми атомами неметалла (фтора). Электроотрицательность атомов одинакова ($Δχ = 0$), поэтому общая электронная пара не смещается ни к одному из атомов. Такая связь называется ковалентной неполярной.
Атом фтора (F) находится в 17-й группе периодической таблицы и имеет 7 валентных электронов. Для завершения внешней электронной оболочки до октета каждому атому фтора не хватает одного электрона. Атомы образуют одну общую электронную пару, формируя одинарную связь.
Электронная формула:
$ \large :\stackrel{..}{\underset{..}{F}} - \stackrel{..}{\underset{..}{F}}: $
Ответ: ковалентная неполярная связь.
$P_4$
Химическая связь в молекуле белого фосфора $P_4$ образована четырьмя одинаковыми атомами неметалла (фосфора). Связь между одинаковыми атомами является ковалентной неполярной.
Атом фосфора (P) находится в 15-й группе и имеет 5 валентных электронов. В молекуле $P_4$ атомы фосфора расположены в вершинах тетраэдра. Каждый атом фосфора образует три одинарные связи с тремя другими атомами и имеет одну неподеленную электронную пару, завершая свой октет.
Электронная формула (описание): Молекула имеет форму тетраэдра, в каждой из четырех вершин которого находится атом фосфора. Каждый атом фосфора связан одинарными связями с тремя другими и имеет одну неподеленную электронную пару.
Ответ: ковалентная неполярная связь.
$CO_2$
Химическая связь в молекуле диоксида углерода $CO_2$ образована атомами разных неметаллов: углерода (C) и кислорода (O). Электроотрицательность кислорода ($χ_O = 3,44$) выше, чем у углерода ($χ_C = 2,55$). Общие электронные пары смещены в сторону более электроотрицательного атома кислорода. Такая связь является ковалентной полярной.
Атом углерода (С) имеет 4 валентных электрона, атом кислорода (O) — 6. Для достижения октета углерод образует две двойные связи с двумя атомами кислорода.
Электронная формула:
$ \large :\stackrel{..}{O}=C=\stackrel{..}{O}: $
Ответ: ковалентная полярная связь.
$CaO$
Химическая связь в оксиде кальция $CaO$ образована атомом типичного металла (кальций, Ca) и атомом активного неметалла (кислород, O). Разница в их электроотрицательностях очень велика ($χ_{Ca} = 1,00$; $χ_O = 3,44$; $Δχ = 2,44$). Атом кальция полностью отдает два своих валентных электрона атому кислорода, превращаясь в катион $Ca^{2+}$, а кислород, принимая электроны, становится анионом $O^{2-}$. Связь, возникающая за счет электростатического притяжения ионов, называется ионной.
Для ионных соединений электронные формулы, показывающие общие электронные пары, не составляют. Соединение состоит из ионов: $[Ca]^{2+}[:\stackrel{..}{\underset{..}{O}}:]^{2-}$
Ответ: ионная связь.
$H_2S$
Химическая связь в молекуле сероводорода $H_2S$ образована атомами разных неметаллов: водорода (H) и серы (S). Электроотрицательность серы ($χ_S = 2,58$) больше, чем у водорода ($χ_H = 2,20$). Общие электронные пары смещены к атому серы. Такая связь является ковалентной полярной.
Атом серы (S) имеет 6 валентных электронов, атом водорода (H) — 1. Атом серы образует две одинарные связи с двумя атомами водорода и имеет две неподеленные электронные пары для завершения октета.
Электронная формула:
$ \large H - \stackrel{..}{\underset{..}{S}} - H $
Ответ: ковалентная полярная связь.
$PCl_5$
Химическая связь в молекуле пентахлорида фосфора $PCl_5$ образована атомами разных неметаллов: фосфора (P) и хлора (Cl). Электроотрицательность хлора ($χ_{Cl} = 3,16$) выше, чем у фосфора ($χ_P = 2,19$). Общие электронные пары смещены к атомам хлора. Такая связь является ковалентной полярной.
Атом фосфора (P) имеет 5 валентных электронов, атом хлора (Cl) — 7. Атом фосфора образует пять одинарных связей с пятью атомами хлора. Это пример соединения с расширенным октетом у центрального атома, так как фосфор окружают 10 валентных электронов.
Электронная формула (описание): Молекула имеет форму тригональной бипирамиды. Центральный атом фосфора (P) образует пять одинарных ковалентных связей с пятью атомами хлора (Cl). У центрального атома фосфора нет неподеленных электронных пар. Каждый из пяти атомов хлора имеет по 3 неподеленные электронные пары, что дополняет его электронную оболочку до октета.
Ответ: ковалентная полярная связь.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 3 расположенного на странице 34 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 34), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.
















