Номер 4, страница 31 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2026
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава I. Важнейшие химические понятия и законы. Параграф 6. Валентность и валентные возможности атомов. Подумайте, ответьте, выполните... - номер 4, страница 31.
№4 (с. 31)
Условие. №4 (с. 31)
скриншот условия

4. Составьте электронные схемы, отражающие валентность азота в азотной кислоте и валентность углерода и кислорода в оксиде углерода(II).
Решение. №4 (с. 31)
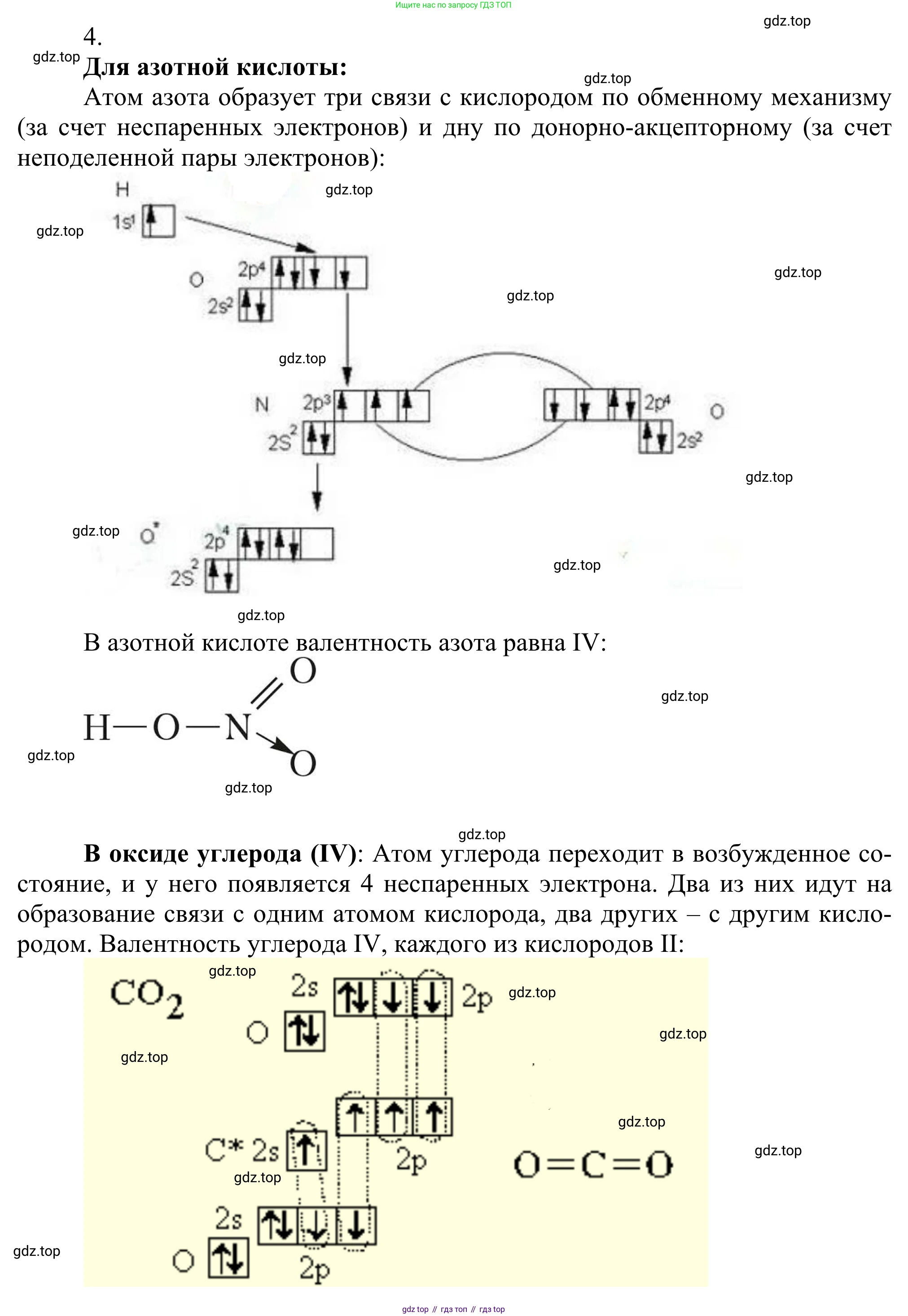
Решение 2. №4 (с. 31)
Валентность азота в азотной кислоте
Решение
Азотная кислота имеет химическую формулу $HNO_3$. Для определения валентности азота необходимо составить электронную или структурную схему молекулы.
Электронные конфигурации валентных оболочек атомов, входящих в состав молекулы:
- Азот (N), порядковый номер 7: $2s^22p^3$. Имеет 5 валентных электронов.
- Кислород (O), порядковый номер 8: $2s^22p^4$. Имеет 6 валентных электронов.
- Водород (H), порядковый номер 1: $1s^1$. Имеет 1 валентный электрон.
Атом азота находится во втором периоде, поэтому его максимальная валентность ограничена четырьмя, так как на втором энергетическом уровне имеется только четыре валентные орбитали (одна s- и три p-орбитали). Распаривание $2s^2$-электронов и переход атома в пятивалентное состояние невозможно из-за отсутствия d-подуровня.
В молекуле азотной кислоты атом азота образует четыре химические связи за счет обменного и донорно-акцепторного механизмов:
- Одна одинарная ковалентная связь с атомом кислорода гидроксильной группы ($-OH$). Образуется по обменному механизму.
- Одна двойная ковалентная связь с другим атомом кислорода ($N=O$). Образуется по обменному механизму.
- Одна ковалентная связь с третьим атомом кислорода, образованная по донорно-акцепторному механизму ($N \rightarrow O$). Атом азота (донор) предоставляет свою неподеленную электронную пару, а атом кислорода (акцептор) — свободную орбиталь.
Таким образом, общее число связей, образованных атомом азота, равно $1 + 2 + 1 = 4$. Следовательно, валентность азота в азотной кислоте равна IV. Кислород во всех случаях проявляет валентность II, а водород - I.
Электронная схема (структура Льюиса), отражающая валентность азота (связи показаны парами электронов-точек):
..
:O:
..
H : Ö : N :: O:
В данной схеме показано, что атом азота связан с тремя атомами кислорода, образуя в сумме четыре ковалентные связи.
Ответ: Валентность азота в азотной кислоте равна IV. Электронная схема показывает, что атом азота образует четыре ковалентные связи: одну одинарную, одну двойную и одну, образованную по донорно-акцепторному механизму.
Валентность углерода и кислорода в оксиде углерода(II)
Решение
Оксид углерода(II), также известный как угарный газ, имеет химическую формулу $CO$.
Электронные конфигурации валентных оболочек атомов:
- Углерод (C), порядковый номер 6: $2s^22p^2$. Имеет 4 валентных электрона.
- Кислород (O), порядковый номер 8: $2s^22p^4$. Имеет 6 валентных электронов.
В молекуле $CO$ между атомами углерода и кислорода образуется тройная связь. Механизм ее образования следующий:
- Две ковалентные связи образуются по обменному механизму. Два неспаренных p-электрона атома углерода спариваются с двумя неспаренными p-электронами атома кислорода. В результате образуется двойная связь ($C=O$).
- Третья связь образуется по донорно-акцепторному механизму. Для достижения устойчивой электронной конфигурации (октета) у обоих атомов, атом кислорода (донор) предоставляет одну из своих неподеленных электронных пар атому углерода (акцептор) на его вакантную p-орбиталь.
В итоге между атомами углерода и кислорода образуется тройная связь ($C \equiv O$).
Электронная схема молекулы $CO$, где общие электронные пары (связи) показаны двоеточиями:
:C:::O:
Так как валентность определяется числом образованных ковалентных связей, и в данном случае каждый атом образует три связи, то валентность и углерода, и кислорода равна III.
Ответ: В оксиде углерода(II) валентность углерода равна III и валентность кислорода равна III. Электронная схема молекулы показывает наличие тройной связи между атомами.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 31 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 31), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















