Номер 4, страница 48 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава II. Строение вещества. Параграф 10. Строение кристаллов. Кристаллические решётки. Подумайте, ответьте, выполните... - номер 4, страница 48.
№4 (с. 48)
Условие. №4 (с. 48)
скриншот условия

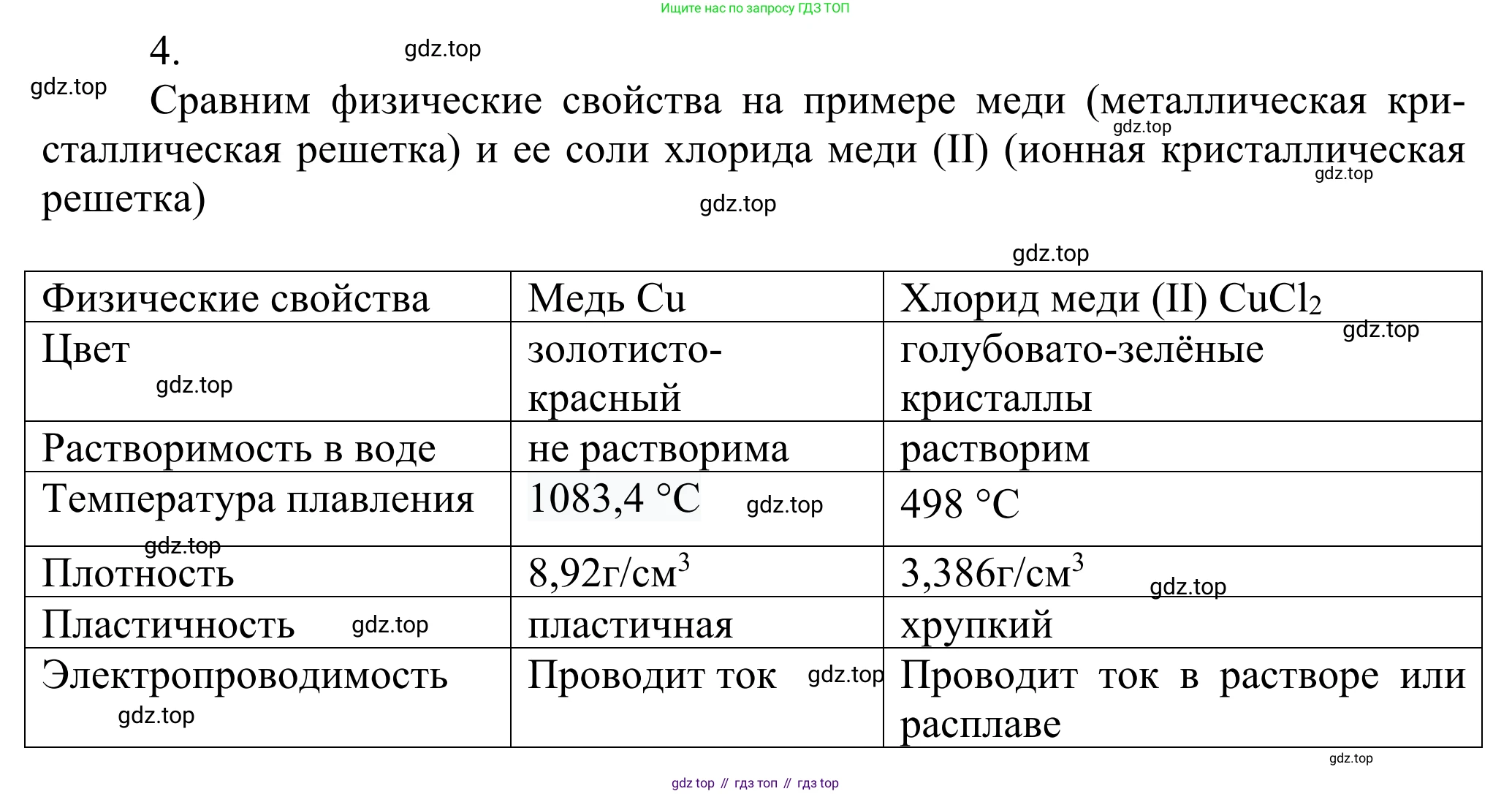
4. На конкретных примерах сравните физические свойства веществ, существующих в виде металлических и ионных кристаллов.
Решение. №4 (с. 48)
Решение 2. №4 (с. 48)
Физические свойства веществ напрямую зависят от типа их кристаллической решетки и природы химической связи. Сравним свойства веществ с металлической и ионной решеткой на конкретных примерах: меди ($Cu$) как представителя металлов и хлорида натрия ($NaCl$, поваренная соль) как представителя ионных соединений.
В узлах металлической решетки меди находятся положительно заряженные ионы $Cu^{n+}$, а между ними свободно перемещаются обобщенные валентные электроны, образуя так называемый "электронный газ". Эти электроны связывают всю структуру воедино. В узлах ионной решетки хлорида натрия находятся строго чередующиеся положительные ионы натрия ($Na^+$) и отрицательные ионы хлора ($Cl^-$), удерживаемые сильными электростатическими силами притяжения.
Твердость, пластичность и хрупкость
Вещества с ионной решеткой, как правило, твердые, но в то же время хрупкие. Например, кристалл соли ($NaCl$) можно раскрошить. Твердость обусловлена сильным притяжением между ионами. Хрупкость объясняется тем, что при механическом воздействии (ударе) происходит сдвиг слоев решетки. В результате одноименно заряженные ионы оказываются рядом, что приводит к резкому возникновению сил отталкивания и разрушению (раскалыванию) кристалла.
Вещества с металлической решеткой, например медь ($Cu$), характеризуются пластичностью — способностью изменять форму под нагрузкой без разрушения (ковкость, тягучесть). При механическом воздействии слои ионов в металле могут смещаться друг относительно друга, но связь не разрывается, так как "электронный газ" продолжает удерживать их вместе в новом положении.
Ответ: Ионные кристаллы (например, $NaCl$) твердые, но хрупкие, в то время как металлические кристаллы (например, $Cu$) пластичны.
Температуры плавления и кипения
Для веществ с ионной решеткой характерны очень высокие температуры плавления. Чтобы расплавить хлорид натрия, его нужно нагреть до 801 °C. Это связано с тем, что для разрушения прочной кристаллической решетки, удерживаемой мощными электростатическими силами, требуется большое количество энергии.
Большинство металлов также являются тугоплавкими. Например, температура плавления меди составляет 1085 °C. Металлическая связь также является прочной. Однако диапазон температур плавления у металлов очень широк: от ртути ($Hg$, tпл = -39 °C) до вольфрама ($W$, tпл = 3422 °C).
Ответ: И для металлических, и для ионных кристаллов характерны, как правило, высокие температуры плавления из-за прочности химических связей в них.
Электропроводность
Ионные кристаллы в твердом состоянии являются диэлектриками (не проводят электрический ток). Это объясняется тем, что ионы жестко зафиксированы в узлах решетки и не могут перемещаться для переноса заряда. Однако при плавлении или растворении в воде ($NaCl$) решетка разрушается, ионы становятся подвижными, и такие расплавы/растворы хорошо проводят электрический ток.
Металлы (например, $Cu$) отлично проводят электрический ток как в твердом, так и в жидком (расплавленном) состоянии. Это их характерное свойство обусловлено наличием свободных электронов ("электронного газа"), которые под действием электрического поля начинают упорядоченно двигаться, создавая электрический ток.
Ответ: Металлы проводят ток в твердом и жидком состоянии, а ионные соединения — только в виде расплавов или растворов.
Растворимость в воде
Многие вещества с ионной кристаллической решеткой, включая хлорид натрия, хорошо растворяются в полярных растворителях, таких как вода. Полярные молекулы воды ($H_2O$) притягиваются к ионам на поверхности кристалла, окружают их (гидратируют) и "вырывают" из решетки, что приводит к ее разрушению и переходу вещества в раствор.
Металлы, в том числе и медь, в воде нерастворимы, так как прочная металлическая связь не может быть разрушена взаимодействием с молекулами воды.
Ответ: Многие ионные соединения хорошо растворимы в воде, в то время как металлы в воде нерастворимы.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 48 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 48), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















