Номер 4, страница 58 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава III. Химические реакции. Параграф 12. Классификация химических реакций. Подумайте, ответьте, выполните... - номер 4, страница 58.
№4 (с. 58)
Условие. №4 (с. 58)
скриншот условия

4. Расставьте коэффициенты методом электронного баланса в схеме окислительно-восстановительной реакции
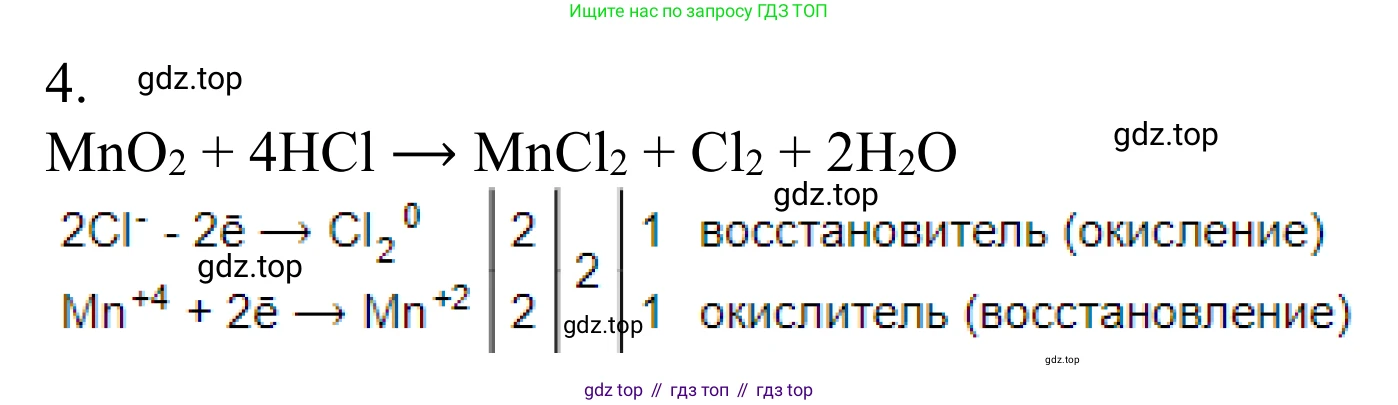
$HCl + MnO_2 \rightarrow MnCl_2 + Cl_2 + H_2O$
Укажите окислитель и восстановитель.
Решение. №4 (с. 58)
Решение 2. №4 (с. 58)
Решение
Для того чтобы расставить коэффициенты в уравнении окислительно-восстановительной реакции методом электронного баланса, выполним следующие шаги:
1. Определим степени окисления каждого элемента в реагентах и продуктах, чтобы найти элементы, которые их изменили.
H$^{+1}$Cl$^{-1}$ + Mn$^{+4}$O$_{2}^{-2}$ → Mn$^{+2}$Cl$_{2}^{-1}$ + Cl$_{2}^{0}$ + H$_{2}^{+1}$O$^{-2}$
Изменения степеней окисления произошли у марганца (Mn) и хлора (Cl):
- Марганец (Mn) понизил свою степень окисления с +4 до +2.
- Хлор (Cl) повысил свою степень окисления с -1 до 0.
2. Составим полуреакции окисления и восстановления.
Марганец принимает электроны, его степень окисления понижается — это процесс восстановления.
Mn$^{+4}$ + 2e$^{-}$ → Mn$^{+2}$
Хлор отдает электроны, его степень окисления повышается — это процесс окисления. Так как в продуктах образуется молекула Cl₂, в полуреакцию вступают два иона хлора.
2Cl$^{-1}$ - 2e$^{-}$ → Cl$_{2}^{0}$
3. Составим электронный баланс, чтобы найти коэффициенты. Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем.
Mn$^{+4}$ + 2e$^{-}$ → Mn$^{+2}$ | 2 | 1 | окислитель, восстановление
2Cl$^{-1}$ - 2e$^{-}$ → Cl$_{2}^{0}$ | 2 | 1 | восстановитель, окисление
Количество принятых и отданных электронов равно (по 2 электрона), поэтому наименьшее общее кратное равно 2, а множители в балансе равны 1.
4. Расставим коэффициенты в уравнении реакции на основе баланса.
Коэффициент 1 (который обычно не пишется) ставим перед MnO₂ и MnCl₂, а также перед Cl₂.
HCl + 1MnO₂ → 1MnCl₂ + 1Cl₂ + H₂O
Теперь уравняем остальные атомы. В правой части уравнения 2 атома хлора в MnCl₂ и 2 атома хлора в Cl₂, что в сумме составляет 4 атома. Следовательно, в левой части перед HCl нужно поставить коэффициент 4.
4HCl + MnO₂ → MnCl₂ + Cl₂ + H₂O
5. Уравняем количество атомов водорода и кислорода.
В левой части 4 атома водорода (в 4HCl). Чтобы уравнять их, в правой части перед H₂O ставим коэффициент 2 (так как 2 × 2 = 4 атома H).
4HCl + MnO₂ → MnCl₂ + Cl₂ + 2H₂O
Проверяем количество атомов кислорода: в левой части 2 атома (в MnO₂), в правой части также 2 атома (в 2H₂O). Все атомы сбалансированы.
6. Определим окислитель и восстановитель.
Окислитель — это вещество, в состав которого входит элемент, принимающий электроны (понижающий свою степень окисления). В данной реакции Mn$^{+4}$ в составе MnO₂ принимает электроны.
Восстановитель — это вещество, в состав которого входит элемент, отдающий электроны (повышающий свою степень окисления). В данной реакции Cl$^{-1}$ в составе HCl отдает электроны.
Ответ:
Сбалансированное уравнение реакции: 4HCl + MnO₂ → MnCl₂ + Cl₂ + 2H₂O.
Окислитель: MnO₂ (оксид марганца(IV)) за счёт Mn$^{+4}$.
Восстановитель: HCl (соляная кислота) за счёт Cl$^{-1}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 58 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 58), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.
















