Номер 2, страница 88 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава IV. Растворы. Параграф 19. Электролитическая диссоциация. Водородный показатель. Подумайте, ответьте, выполните... - номер 2, страница 88.
№2 (с. 88)
Условие. №2 (с. 88)
скриншот условия

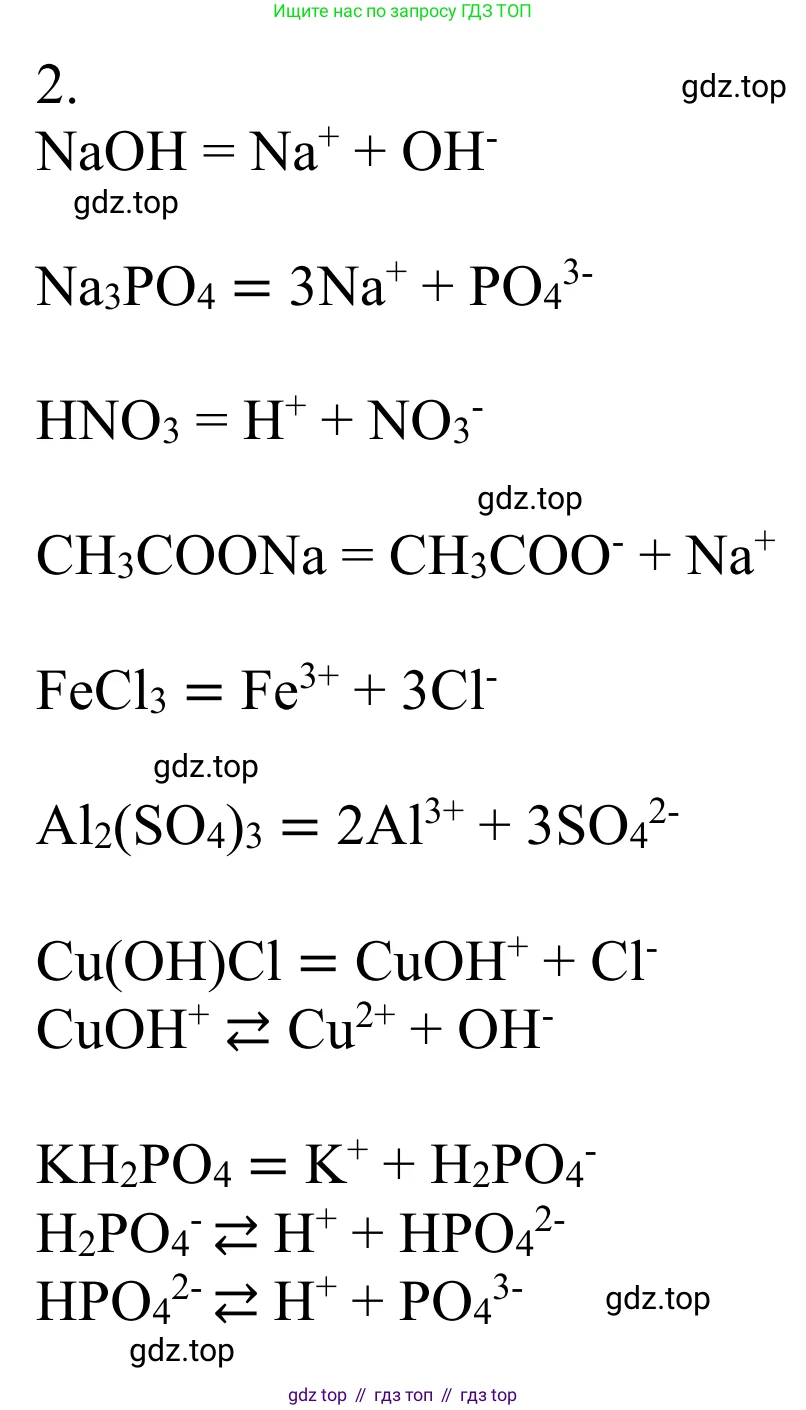
2. Составьте уравнения диссоциации следующих электролитов: $NaOH$, $Na_3PO_4$, $HNO_3$, $CH_3COONa$, $FeCl_3$, $Al_2(SO_4)_3$, $Cu(OH)Cl$, $KH_2PO_4$.
Решение. №2 (с. 88)
Решение 2. №2 (с. 88)
NaOH
Гидроксид натрия (едкий натр) — сильное основание (щёлочь), является сильным электролитом и в водных растворах диссоциирует полностью и необратимо в одну ступень.
Ответ: $NaOH \rightarrow Na^+ + OH^-$
Na₃PO₄
Фосфат натрия — средняя соль, образованная сильным основанием (NaOH) и слабой трёхосновной кислотой (H₃PO₄). Как и большинство солей, является сильным электролитом и диссоциирует в одну ступень на катионы металла и анионы кислотного остатка.
Ответ: $Na_3PO_4 \rightarrow 3Na^+ + PO_4^{3-}$
HNO₃
Азотная кислота — сильная одноосновная кислота, является сильным электролитом и в водных растворах диссоциирует полностью на ионы водорода и нитрат-ионы.
Ответ: $HNO_3 \rightarrow H^+ + NO_3^-$
CH₃COONa
Ацетат натрия — соль, образованная слабой одноосновной кислотой (уксусной, CH₃COOH) и сильным основанием (NaOH). Является сильным электролитом и диссоциирует полностью.
Ответ: $CH_3COONa \rightarrow CH_3COO^- + Na^+$
FeCl₃
Хлорид железа(III) — соль, образованная слабым основанием (Fe(OH)₃) и сильной кислотой (HCl). Является сильным электролитом и диссоциирует полностью на ионы.
Ответ: $FeCl_3 \rightarrow Fe^{3+} + 3Cl^-$
Al₂(SO₄)₃
Сульфат алюминия — соль, образованная слабым основанием (Al(OH)₃) и сильной кислотой (H₂SO₄). Является сильным электролитом и диссоциирует в одну ступень.
Ответ: $Al_2(SO_4)_3 \rightarrow 2Al^{3+} + 3SO_4^{2-}$
Cu(OH)Cl
Гидроксид-хлорид меди(II) — это основная соль. Диссоциация основных солей протекает ступенчато. Первая ступень — отщепление аниона кислотного остатка, протекает необратимо. Вторая ступень — диссоциация гидроксокатиона, протекает обратимо.
Ответ:
I ступень: $Cu(OH)Cl \rightarrow [Cu(OH)]^+ + Cl^-$
II ступень: $[Cu(OH)]^+ \rightleftharpoons Cu^{2+} + OH^-$
KH₂PO₄
Дигидрофосфат калия — это кислая соль, образованная сильным основанием (KOH) и слабой многоосновной кислотой (H₃PO₄). Диссоциация кислых солей протекает ступенчато. Первая ступень — диссоциация соли на катион металла и кислый анион, протекает необратимо. Последующие ступени — диссоциация кислого аниона по типу слабой кислоты, протекают обратимо.
Ответ:
I ступень: $KH_2PO_4 \rightarrow K^+ + H_2PO_4^-$
II ступень: $H_2PO_4^- \rightleftharpoons H^+ + HPO_4^{2-}$
III ступень: $HPO_4^{2-} \rightleftharpoons H^+ + PO_4^{3-}$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 2 расположенного на странице 88 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 88), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.
















