Номер 3, страница 92 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава IV. Растворы. Параграф 20. Реакции ионного обмена. Подумайте, ответьте, выполните... - номер 3, страница 92.
№3 (с. 92)
Условие. №3 (с. 92)
скриншот условия

3. Приведите по два примера уравнений реакций ионного обмена, соответствующих кратким ионным уравнениям:
а) $H^{+} + OH^{-} = H_2O$
б) $Pb^{2+} + 2OH^{-} = Pb(OH)_2 \downarrow$
Решение. №3 (с. 92)
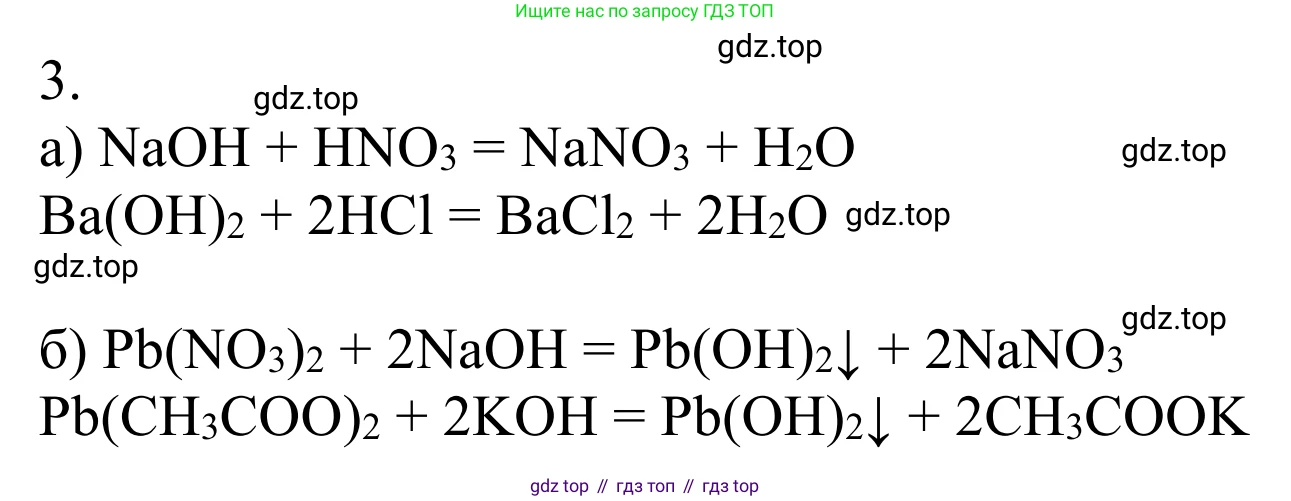
Решение 2. №3 (с. 92)
Решение
а) $H^+ + OH^- = H_2O$
Данное краткое ионное уравнение соответствует реакции нейтрализации, протекающей между сильной кислотой (которая диссоциирует с образованием катионов водорода $H^+$) и сильным основанием (которое диссоциирует с образованием гидроксид-анионов $OH^-$). Продуктами такой реакции являются вода (слабый электролит, поэтому в ионных уравнениях записывается в молекулярном виде) и растворимая соль. Ионы, образующие соль, в реакции не участвуют и называются ионами-наблюдателями.
Пример 1: Взаимодействие соляной кислоты (сильная кислота) и гидроксида натрия (сильное основание).
Молекулярное уравнение реакции:
$HCl + NaOH \rightarrow NaCl + H_2O$
Полное ионное уравнение (все сильные электролиты записываем в виде ионов):
$H^+ + Cl^- + Na^+ + OH^- \rightarrow Na^+ + Cl^- + H_2O$
Ионы $Na^+$ и $Cl^-$ присутствуют в левой и правой частях уравнения, поэтому мы их сокращаем. В результате получаем краткое ионное уравнение:
$H^+ + OH^- = H_2O$
Пример 2: Взаимодействие серной кислоты (сильная кислота) и гидроксида калия (сильное основание).
Молекулярное уравнение реакции (необходимо расставить коэффициенты):
$H_2SO_4 + 2KOH \rightarrow K_2SO_4 + 2H_2O$
Полное ионное уравнение:
$2H^+ + SO_4^{2-} + 2K^+ + 2OH^- \rightarrow 2K^+ + SO_4^{2-} + 2H_2O$
Сокращаем ионы-наблюдатели $K^+$ и $SO_4^{2-}$. Делим все коэффициенты на 2:
$H^+ + OH^- = H_2O$
Ответ: 1) $HCl + NaOH = NaCl + H_2O$; 2) $H_2SO_4 + 2KOH = K_2SO_4 + 2H_2O$.
б) $Pb^{2+} + 2OH^- = Pb(OH)_2\downarrow$
Данное краткое ионное уравнение описывает реакцию ионного обмена, в результате которой образуется нерастворимое вещество (осадок) — гидроксид свинца(II) $Pb(OH)_2$. Для проведения такой реакции необходимо использовать растворимую соль свинца (источник ионов $Pb^{2+}$) и растворимое сильное основание, то есть щёлочь (источник ионов $OH^-$).
Пример 1: Взаимодействие нитрата свинца(II) (растворимая соль) и гидроксида натрия (щёлочь).
Молекулярное уравнение реакции (с расстановкой коэффициентов):
$Pb(NO_3)_2 + 2NaOH \rightarrow Pb(OH)_2\downarrow + 2NaNO_3$
Полное ионное уравнение (учитываем, что $Pb(OH)_2$ — осадок и не диссоциирует):
$Pb^{2+} + 2NO_3^- + 2Na^+ + 2OH^- \rightarrow Pb(OH)_2\downarrow + 2Na^+ + 2NO_3^-$
Сокращаем ионы-наблюдатели $Na^+$ и $NO_3^-$ и получаем краткое ионное уравнение:
$Pb^{2+} + 2OH^- = Pb(OH)_2\downarrow$
Пример 2: Взаимодействие ацетата свинца(II) (растворимая соль) и гидроксида бария (щёлочь).
Молекулярное уравнение реакции:
$Pb(CH_3COO)_2 + Ba(OH)_2 \rightarrow Pb(OH)_2\downarrow + Ba(CH_3COO)_2$
Полное ионное уравнение:
$Pb^{2+} + 2CH_3COO^- + Ba^{2+} + 2OH^- \rightarrow Pb(OH)_2\downarrow + Ba^{2+} + 2CH_3COO^-$
Сокращаем ионы-наблюдатели $Ba^{2+}$ и $CH_3COO^-$:
$Pb^{2+} + 2OH^- = Pb(OH)_2\downarrow$
Ответ: 1) $Pb(NO_3)_2 + 2NaOH = Pb(OH)_2\downarrow + 2NaNO_3$; 2) $Pb(CH_3COO)_2 + Ba(OH)_2 = Pb(OH)_2\downarrow + Ba(CH_3COO)_2$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 3 расположенного на странице 92 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 92), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















