Номер 12, страница 124 - гдз по химии 8 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103484-4
Популярные ГДЗ в 8 классе
Проверочные работы. Тема V. Химическая связь. Окислительно-восстановительные реакции. Типы химических связей. Вариант 3 - номер 12, страница 124.
№12 (с. 124)
Условие. №12 (с. 124)
скриншот условия

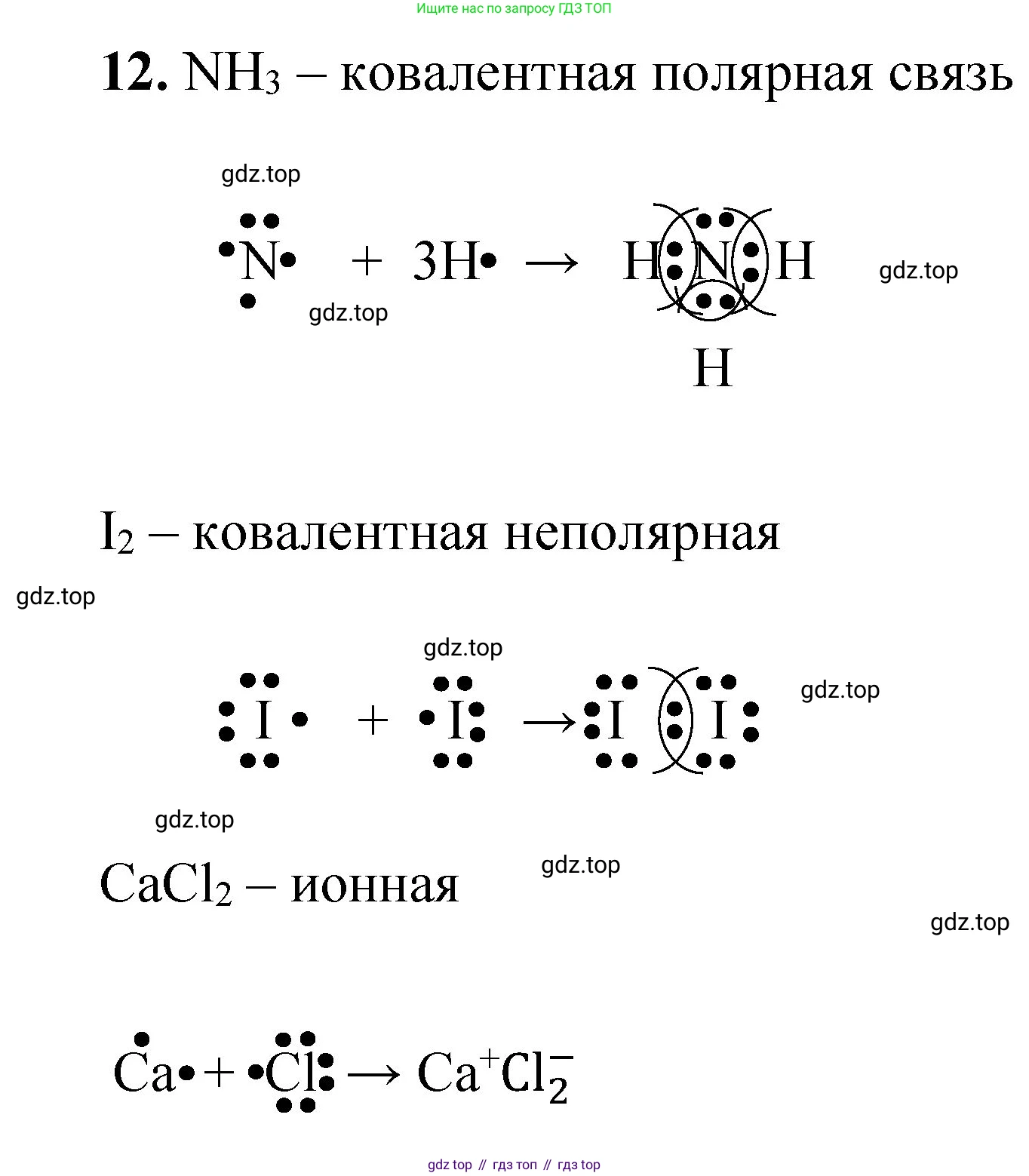
12. Определите тип химической связи в веществах, формулы которых: $CaCl_2$, $NH_3$, $I_2$. Составьте схемы образования химических связей в этих веществах.
Решение. №12 (с. 124)
Решение 2. №12 (с. 124)
CaCl₂ (хлорид кальция)
Химическая связь в хлориде кальция образована между атомом типичного металла – кальция ($Ca$) и атомами типичного неметалла – хлора ($Cl$). Связь между атомами металла и неметалла, которые значительно отличаются по электроотрицательности, является ионной. Электроотрицательность кальция $\chi(Ca) = 1.0$, а хлора $\chi(Cl) = 3.16$.
Схема образования ионной связи в CaCl₂:
Атом кальция ($Ca$) расположен во второй группе периодической системы и имеет на внешнем электронном слое 2 валентных электрона. Чтобы достичь стабильной электронной конфигурации, атом кальция отдает эти 2 электрона, превращаясь в положительно заряженный ион (катион) $Ca^{2+}$.
$Ca^0 - 2e^- \rightarrow Ca^{2+}$
Атом хлора ($Cl$) расположен в семнадцатой группе и имеет 7 валентных электронов. Для завершения своего внешнего электронного слоя атому хлора необходимо принять 1 электрон, в результате чего он превращается в отрицательно заряженный ион (анион) $Cl^{-}$.
$Cl^0 + 1e^- \rightarrow Cl^{-}$
Для образования электронейтрального соединения один атом кальция взаимодействует с двумя атомами хлора. Атом кальция отдает по одному электрону каждому из двух атомов хлора. Возникшие ионы $Ca^{2+}$ и $2Cl^{-}$ притягиваются друг к другу за счет электростатических сил, образуя ионное соединение $CaCl_2$.
Схема образования с помощью электронных точек (структуры Льюиса):
$Ca\cdot + 2 \cdot \ddot{Cl}: \rightarrow [Ca]^{2+} + 2[:\ddot{Cl}:]^{-}$
Ответ: тип химической связи в $CaCl_2$ – ионная.
NH₃ (аммиак)
Химическая связь в аммиаке образована между атомами неметаллов – азота ($N$) и водорода ($H$). Электроотрицательность азота ($\chi(N) = 3.04$) больше, чем у водорода ($\chi(H) = 2.20$). Связь между атомами разных неметаллов является ковалентной полярной.
Схема образования ковалентной полярной связи в NH₃:
Атом азота ($N$), находясь в пятнадцатой группе, имеет 5 валентных электронов. Для завершения внешнего уровня (октета) ему не хватает 3 электронов. Атом водорода ($H$) имеет 1 валентный электрон, и ему не хватает 1 электрона для завершения своего энергетического уровня (дуплета).
Атом азота образует три общие электронные пары с тремя атомами водорода. Каждая связь $N-H$ образуется за счет одного электрона от атома азота и одного электрона от атома водорода.
Схема образования с помощью электронных точек:
$\cdot \ddot{N} \cdot + 3 H \cdot \rightarrow H:\overset{\Large \cdot\cdot}{\underset{\Large H}{N}}:H$
В результате образуются три ковалентные связи. Так как азот более электроотрицателен, общие электронные пары смещены к нему. На атоме азота возникает частичный отрицательный заряд ($\delta^-$), а на атомах водорода – частичные положительные заряды ($\delta^+$). У атома азота остается одна неподеленная электронная пара.
Ответ: тип химической связи в $NH_3$ – ковалентная полярная.
I₂ (йод)
Молекула йода состоит из двух одинаковых атомов неметалла – йода ($I$). Поскольку атомы одинаковы, их электроотрицательности равны ($\chi(I) = 2.66$), и разница электроотрицательностей равна нулю. Связь, образованная между атомами одного и того же химического элемента-неметалла, является ковалентной неполярной.
Схема образования ковалентной неполярной связи в I₂:
Атом йода ($I$) является галогеном (семнадцатая группа) и имеет 7 валентных электронов. Для завершения внешнего энергетического уровня каждому атому йода недостает одного электрона.
Два атома йода объединяются, образуя одну общую электронную пару. Каждый атом предоставляет по одному неспаренному электрону для создания этой связи.
Схема образования с помощью электронных точек:
$:\ddot{I}\cdot + \cdot \ddot{I}: \rightarrow :\ddot{I}:\ddot{I}:$
Общая электронная пара принадлежит в равной степени обоим атомам, поэтому смещения электронной плотности не происходит и связь является неполярной.
Ответ: тип химической связи в $I_2$ – ковалентная неполярная.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 12 расположенного на странице 124 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №12 (с. 124), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.
















