Номер 2, страница 165 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 4. Изменения, происходящие с веществами. Параграф 28. Химические уравнения - номер 2, страница 165.
№2 (с. 165)
Условие. №2 (с. 165)

Решение. №2 (с. 165)
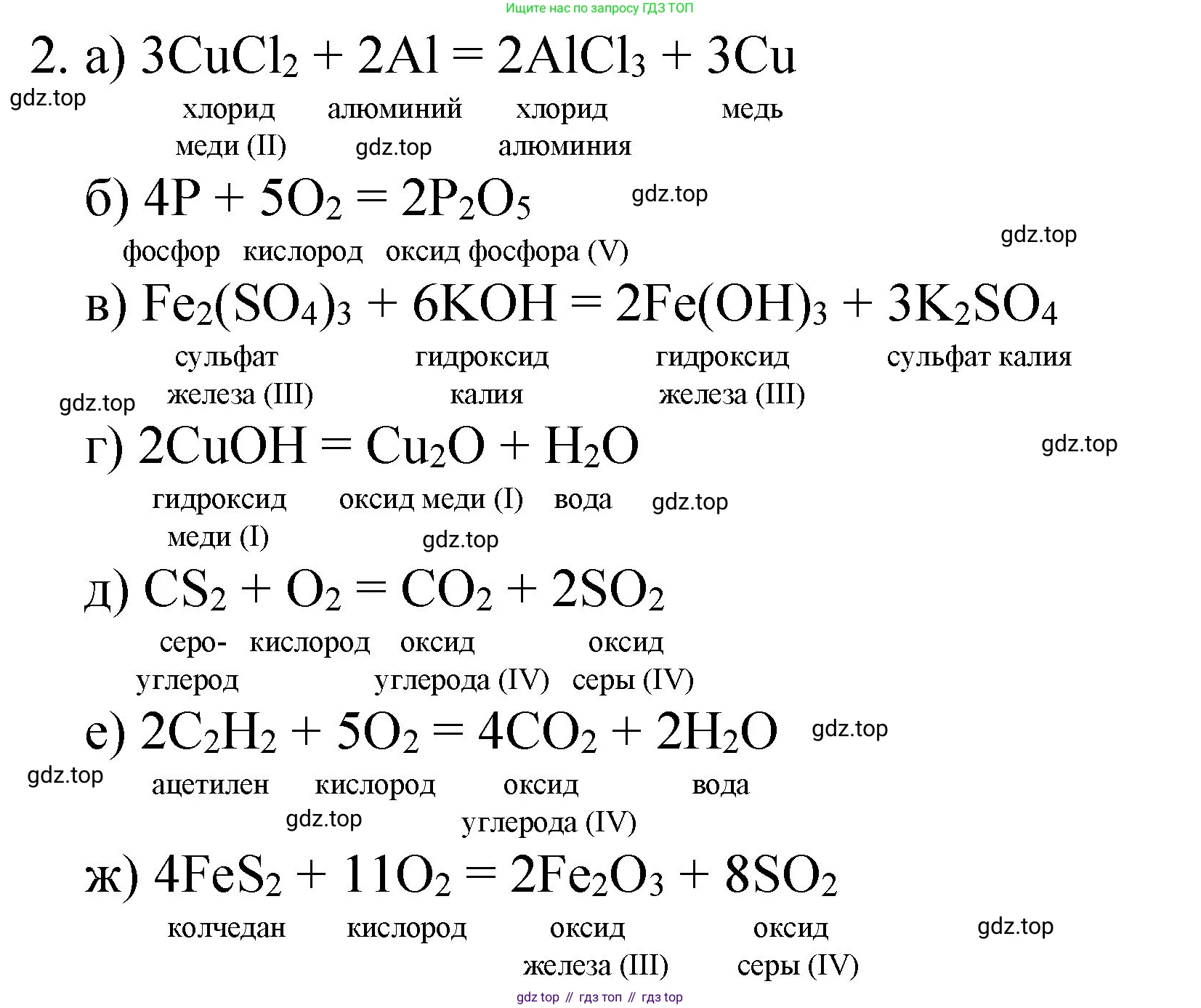
Решение 2. №2 (с. 165)
а) Это реакция замещения, в которой более активный металл алюминий вытесняет менее активную медь из её соли. Для уравнивания сначала находим наименьшее общее кратное для атомов хлора (2 и 3), которое равно 6. Ставим коэффициент 3 перед $\text{CuCl}_2$ и 2 перед $\text{AlCl}_3$. Затем уравниваем количество атомов меди и алюминия, поставив коэффициент 3 перед $\text{Cu}$ и 2 перед $\text{Al}$.
Итоговое уравнение с названиями веществ:
$\underset{\text{хлорид меди(II)}}{3\text{CuCl}_2} + \underset{\text{алюминий}}{2\text{Al}} \xrightarrow{t} \underset{\text{хлорид алюминия}}{2\text{AlCl}_3} + \underset{\text{медь}}{3\text{Cu}}$
Ответ: $3\text{CuCl}_2 + 2\text{Al} \xrightarrow{t} 2\text{AlCl}_3 + 3\text{Cu}$.
б) В реакции горения фосфора образуется оксид фосфора(V). Для уравнивания начинаем с кислорода. Справа 5 атомов, слева 2. Наименьшее общее кратное - 10. Ставим коэффициент 5 перед $\text{O}_2$ и 2 перед $\text{P}_2\text{O}_5$. Теперь справа 4 атома фосфора ($2 \times 2$), значит, слева перед $\text{P}$ ставим коэффициент 4.
Итоговое уравнение с названиями веществ:
$\underset{\text{фосфор}}{4\text{P}} + \underset{\text{кислород}}{5\text{O}_2} \rightarrow \underset{\text{оксид фосфора(V)}}{2\text{P}_2\text{O}_5}$
Ответ: $4\text{P} + 5\text{O}_2 \rightarrow 2\text{P}_2\text{O}_5$.
в) Это реакция ионного обмена. Начнём с уравнивания атомов железа: слева их 2, ставим коэффициент 2 перед $\text{Fe}(\text{OH})_3$. Далее уравниваем сульфат-ионы ($\text{SO}_4^{2-}$): слева их 3, ставим коэффициент 3 перед $\text{K}_2\text{SO}_4$. Теперь справа 6 атомов калия ($3 \times 2$), значит, перед $\text{KOH}$ ставим коэффициент 6. Проверяем гидроксид-ионы ($\text{OH}^-$): слева их 6, и справа их 6 ($2 \times 3$). Уравнение сбалансировано.
Итоговое уравнение с названиями веществ:
$\underset{\text{сульфат железа(III)}}{\text{Fe}_2(\text{SO}_4)_3} + \underset{\text{гидроксид калия}}{6\text{KOH}} \rightarrow \underset{\text{гидроксид железа(III)}}{2\text{Fe}(\text{OH})_3\downarrow} + \underset{\text{сульфат калия}}{3\text{K}_2\text{SO}_4}$
Ответ: $\text{Fe}_2(\text{SO}_4)_3 + 6\text{KOH} \rightarrow 2\text{Fe}(\text{OH})_3\downarrow + 3\text{K}_2\text{SO}_4$.
г) Это реакция разложения гидроксида меди(I) при нагревании. Для уравнивания атомов меди, которых справа 2, ставим коэффициент 2 перед $\text{CuOH}$. Проверяем остальные элементы: слева теперь 2 атома кислорода и 2 атома водорода. Справа также 2 атома кислорода ($1 \text{ в } \text{Cu}_2\text{O} \text{ и } 1 \text{ в } \text{H}_2\text{O}$) и 2 атома водорода. Уравнение сбалансировано.
Итоговое уравнение с названиями веществ:
$\underset{\text{гидроксид меди(I)}}{2\text{CuOH}} \xrightarrow{t} \underset{\text{оксид меди(I)}}{\text{Cu}_2\text{O}} + \underset{\text{вода}}{\text{H}_2\text{O}}$
Ответ: $2\text{CuOH} \xrightarrow{t} \text{Cu}_2\text{O} + \text{H}_2\text{O}$.
д) В реакции горения сероуглерода образуются два оксида. Начнём с уравнивания атомов серы: слева 2 атома, ставим коэффициент 2 перед $\text{SO}_2$. Атом углерода уже уравнен. Теперь считаем атомы кислорода справа: $2 \text{ в } \text{CO}_2 \text{ и } 4 \text{ в } 2\text{SO}_2$, итого 6. Значит, перед $\text{O}_2$ слева ставим коэффициент 3.
Итоговое уравнение с названиями веществ:
$\underset{\text{сероуглерод}}{\text{CS}_2} + \underset{\text{кислород}}{3\text{O}_2} \rightarrow \underset{\text{диоксид углерода}}{\text{CO}_2} + \underset{\text{диоксид серы}}{2\text{SO}_2}$
Ответ: $\text{CS}_2 + 3\text{O}_2 \rightarrow \text{CO}_2 + 2\text{SO}_2$.
е) Это реакция полного сгорания ацетилена. Сначала уравниваем углерод: слева 2 атома, ставим коэффициент 2 перед $\text{CO}_2$. Водород уже уравнен (по 2 атома с каждой стороны). Считаем кислород справа: $4 \text{ в } 2\text{CO}_2 \text{ и } 1 \text{ в } \text{H}_2\text{O}$, итого 5. Чтобы получить 5 атомов кислорода слева, ставим перед $\text{O}_2$ дробный коэффициент $\frac{5}{2}$. Чтобы избавиться от дроби, умножаем все коэффициенты в уравнении на 2.
Итоговое уравнение с названиями веществ:
$\underset{\text{ацетилен}}{2\text{C}_2\text{H}_2} + \underset{\text{кислород}}{5\text{O}_2} \rightarrow \underset{\text{диоксид углерода}}{4\text{CO}_2} + \underset{\text{вода}}{2\text{H}_2\text{O}}$
Ответ: $2\text{C}_2\text{H}_2 + 5\text{O}_2 \rightarrow 4\text{CO}_2 + 2\text{H}_2\text{O}$.
ж) Это реакция обжига пирита (колчедана). Начнём с уравнивания железа, поставив коэффициент 2 перед $\text{FeS}_2$, чтобы получить 2 атома железа, как в $\text{Fe}_2\text{O}_3$. Теперь слева 4 атома серы ($2 \times 2$), поэтому ставим коэффициент 4 перед $\text{SO}_2$. Считаем кислород справа: $3 \text{ в } \text{Fe}_2\text{O}_3 \text{ и } 8 \text{ в } 4\text{SO}_2$, итого 11. Ставим перед $\text{O}_2$ коэффициент $\frac{11}{2}$. Умножаем все коэффициенты на 2, чтобы избавиться от дроби.
Итоговое уравнение с названиями веществ:
$\underset{\text{пирит (колчедан)}}{4\text{FeS}_2} + \underset{\text{кислород}}{11\text{O}_2} \xrightarrow{t} \underset{\text{оксид железа(III)}}{2\text{Fe}_2\text{O}_3} + \underset{\text{диоксид серы}}{8\text{SO}_2}$
Ответ: $4\text{FeS}_2 + 11\text{O}_2 \xrightarrow{t} 2\text{Fe}_2\text{O}_3 + 8\text{SO}_2$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2 расположенного на странице 165 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 165), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















