Номер 3.24, страница 57, часть II - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: II
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть II. Вычисления по химическим уравнениям. 3. Вычисление массы (количества вещества, объема) продукта реакции, если для его получения дан раствор с определенной массовой долей исходного вещества - номер 3.24, страница 57.
№3.24 (с. 57)
Условие. №3.24 (с. 57)
скриншот условия

3.24. Вычислите массу соляной кислоты с массовой долей HCl 10% и количество вещества цинка, при взаимодействии которых выделилось 67,2 л водорода (н. у.).
Решение. №3.24 (с. 57)

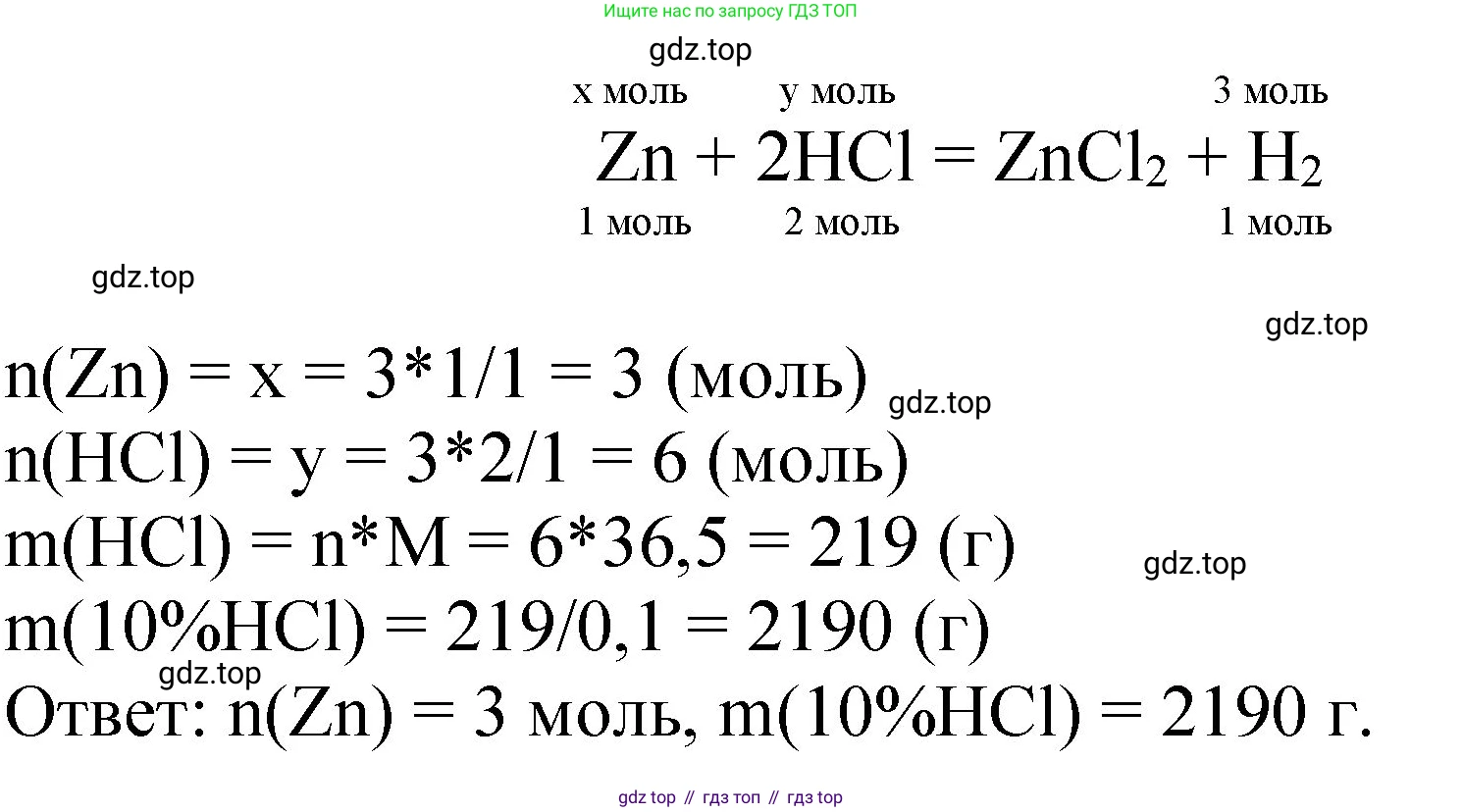
Решение 2. №3.24 (с. 57)
Дано:
$\omega(\text{HCl}) = 10\% = 0.1$
$V(\text{H}_2) = 67,2 \text{ л}$ (н. у.)
Найти:
$m(\text{р-ра HCl}) - ?$
$n(\text{Zn}) - ?$
Решение:
1. Запишем уравнение химической реакции взаимодействия цинка (Zn) с соляной кислотой (HCl):
$ \text{Zn} + 2\text{HCl} \rightarrow \text{ZnCl}_2 + \text{H}_2\uparrow $
2. Найдем количество вещества выделившегося водорода ($H_2$). Поскольку объем газа дан при нормальных условиях (н. у.), мы можем использовать молярный объем газов, который равен $V_m = 22,4 \text{ л/моль}$:
$ n(\text{H}_2) = \frac{V(\text{H}_2)}{V_m} = \frac{67,2 \text{ л}}{22,4 \text{ л/моль}} = 3 \text{ моль} $
3. Используя уравнение реакции, найдем количество вещества цинка ($n(\text{Zn})$) и хлороводорода ($n(\text{HCl})$). Стехиометрические коэффициенты показывают мольное соотношение реагентов и продуктов:
$ \frac{n(\text{Zn})}{1} = \frac{n(\text{HCl})}{2} = \frac{n(\text{H}_2)}{1} $
4. Из соотношения находим количество вещества цинка:
$ n(\text{Zn}) = n(\text{H}_2) = 3 \text{ моль} $
5. Теперь находим количество вещества хлороводорода:
$ n(\text{HCl}) = 2 \cdot n(\text{H}_2) = 2 \cdot 3 \text{ моль} = 6 \text{ моль} $
6. Рассчитаем массу чистого хлороводорода ($m(\text{HCl})$). Для этого сначала определим его молярную массу:
$ M(\text{HCl}) = 1,008 + 35,453 \approx 36,5 \text{ г/моль} $
Теперь можем найти массу HCl:
$ m(\text{HCl}) = n(\text{HCl}) \cdot M(\text{HCl}) = 6 \text{ моль} \cdot 36,5 \text{ г/моль} = 219 \text{ г} $
7. Зная массу чистого вещества и его массовую долю в растворе, вычислим массу всего раствора соляной кислоты:
$ m(\text{р-ра HCl}) = \frac{m(\text{HCl})}{\omega(\text{HCl})} = \frac{219 \text{ г}}{0,10} = 2190 \text{ г} $
Ответ: масса соляной кислоты составляет 2190 г; количество вещества цинка - 3 моль.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 3.24 расположенного на странице 57 для II-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3.24 (с. 57), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), II-й части учебного пособия издательства Просвещение.
















