Номер 3.9, страница 56, часть II - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: II
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть II. Вычисления по химическим уравнениям. 3. Вычисление массы (количества вещества, объема) продукта реакции, если для его получения дан раствор с определенной массовой долей исходного вещества - номер 3.9, страница 56.
№3.9 (с. 56)
Условие. №3.9 (с. 56)
скриншот условия

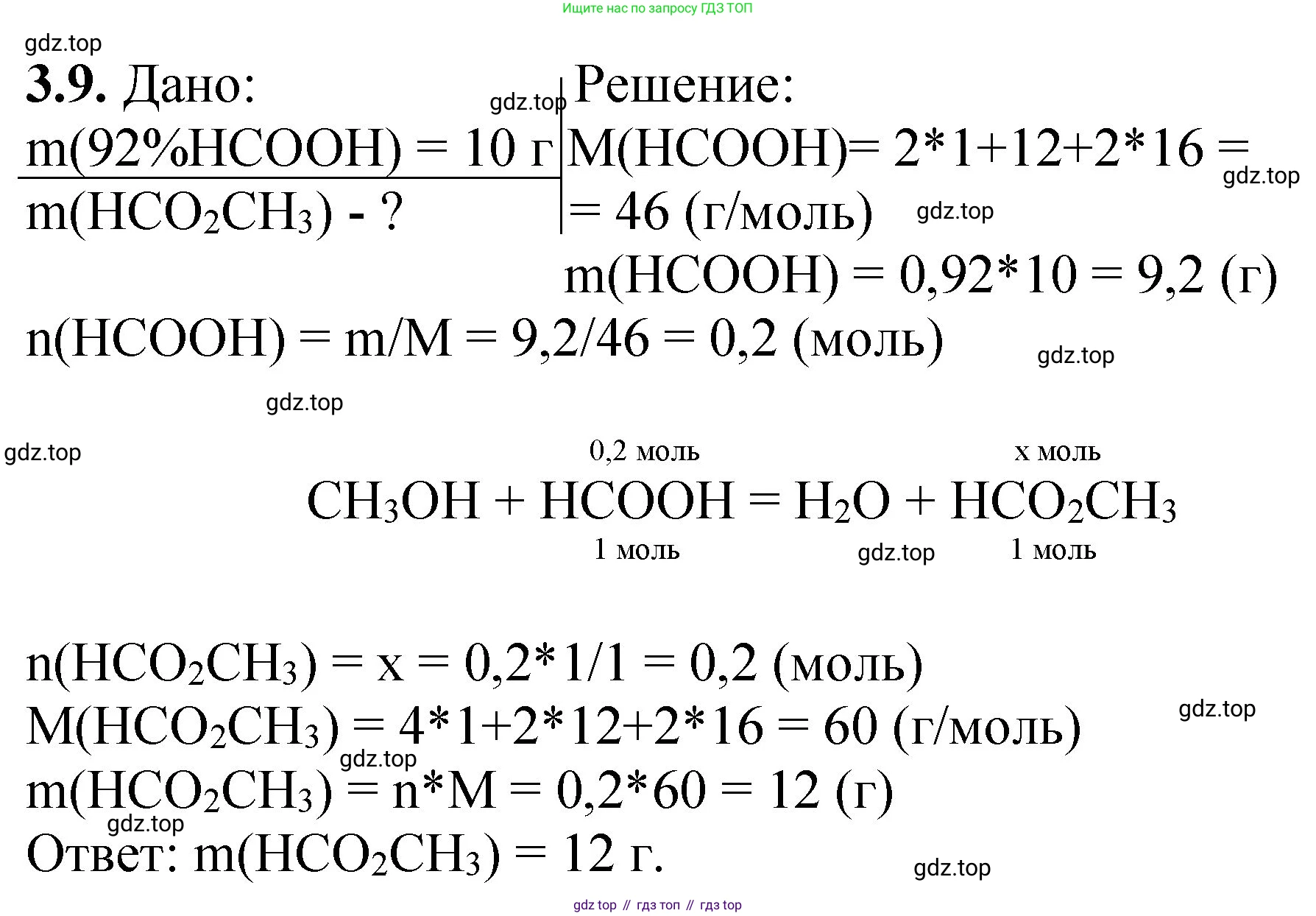
3.9. Сколько граммов эфира должно образоваться при взаимодействии 10 г 92%-ного раствора муравьиной кислоты с метиловым спиртом?
Решение. №3.9 (с. 56)
Решение 2. №3.9 (с. 56)
Дано:
Масса раствора муравьиной кислоты: $m_{р-ра(HCOOH)} = 10 \text{ г}$
Массовая доля муравьиной кислоты: $\omega_{(HCOOH)} = 92\% = 0.92$
Метиловый спирт взят в избытке.
Найти:
Массу эфира: $m_{(эфира)} - ?$
Решение:
Реакция этерификации между муравьиной кислотой (HCOOH) и метиловым спиртом (CH₃OH) приводит к образованию сложного эфира — метилформиата (HCOOCH₃) — и воды (H₂O). Предполагается, что реакция идет до конца (теоретический выход), так как в условии не указана константа равновесия или практический выход. Запишем уравнение реакции:
$HCOOH + CH_3OH \rightleftharpoons HCOOCH_3 + H_2O$
Поскольку метиловый спирт взят в избытке, расчет ведем по муравьиной кислоте, которая является лимитирующим реагентом.
1. Найдем массу чистой муравьиной кислоты в 10 г 92%-ного раствора:
$m_{(HCOOH)} = m_{р-ра(HCOOH)} \times \omega_{(HCOOH)} = 10 \text{ г} \times 0.92 = 9.2 \text{ г}$
2. Рассчитаем молярные массы муравьиной кислоты и образующегося эфира (метилформиата).
Молярная масса муравьиной кислоты (HCOOH):
$M_{(HCOOH)} = Ar(C) + 2 \times Ar(H) + 2 \times Ar(O) = 12.01 + 2 \times 1.01 + 2 \times 16.00 \approx 46 \text{ г/моль}$
Молярная масса метилформиата (HCOOCH₃):
$M_{(HCOOCH_3)} = 2 \times Ar(C) + 4 \times Ar(H) + 2 \times Ar(O) = 2 \times 12.01 + 4 \times 1.01 + 2 \times 16.00 \approx 60 \text{ г/моль}$
3. Найдем количество вещества (число моль) муравьиной кислоты, вступившей в реакцию:
$n_{(HCOOH)} = \frac{m_{(HCOOH)}}{M_{(HCOOH)}} = \frac{9.2 \text{ г}}{46 \text{ г/моль}} = 0.2 \text{ моль}$
4. Согласно уравнению реакции, из 1 моль муравьиной кислоты образуется 1 моль метилформиата. Следовательно, стехиометрическое соотношение количеств веществ равно:
$\frac{n_{(HCOOH)}}{1} = \frac{n_{(HCOOCH_3)}}{1}$
Отсюда, количество вещества образовавшегося эфира равно количеству вещества кислоты:
$n_{(HCOOCH_3)} = n_{(HCOOH)} = 0.2 \text{ моль}$
5. Рассчитаем массу образовавшегося эфира (метилформиата):
$m_{(HCOOCH_3)} = n_{(HCOOCH_3)} \times M_{(HCOOCH_3)} = 0.2 \text{ моль} \times 60 \text{ г/моль} = 12 \text{ г}$
Ответ: должно образоваться 12 г эфира.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 3.9 расположенного на странице 56 для II-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3.9 (с. 56), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), II-й части учебного пособия издательства Просвещение.
















