Номер 5-69, страница 59 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 5. Основные классы неорганических соединений. 5.3. Основания - номер 5-69, страница 59.
№5-69 (с. 59)
Условие. №5-69 (с. 59)
скриншот условия

5-69. Газ, образовавшийся при сгорании 32 г метана $ \text{CH}_4 $, пропустили в раствор гидроксида бария. Вычислите массу образовавшегося карбоната бария.
Решение. №5-69 (с. 59)
Решение 2. №5-69 (с. 59)
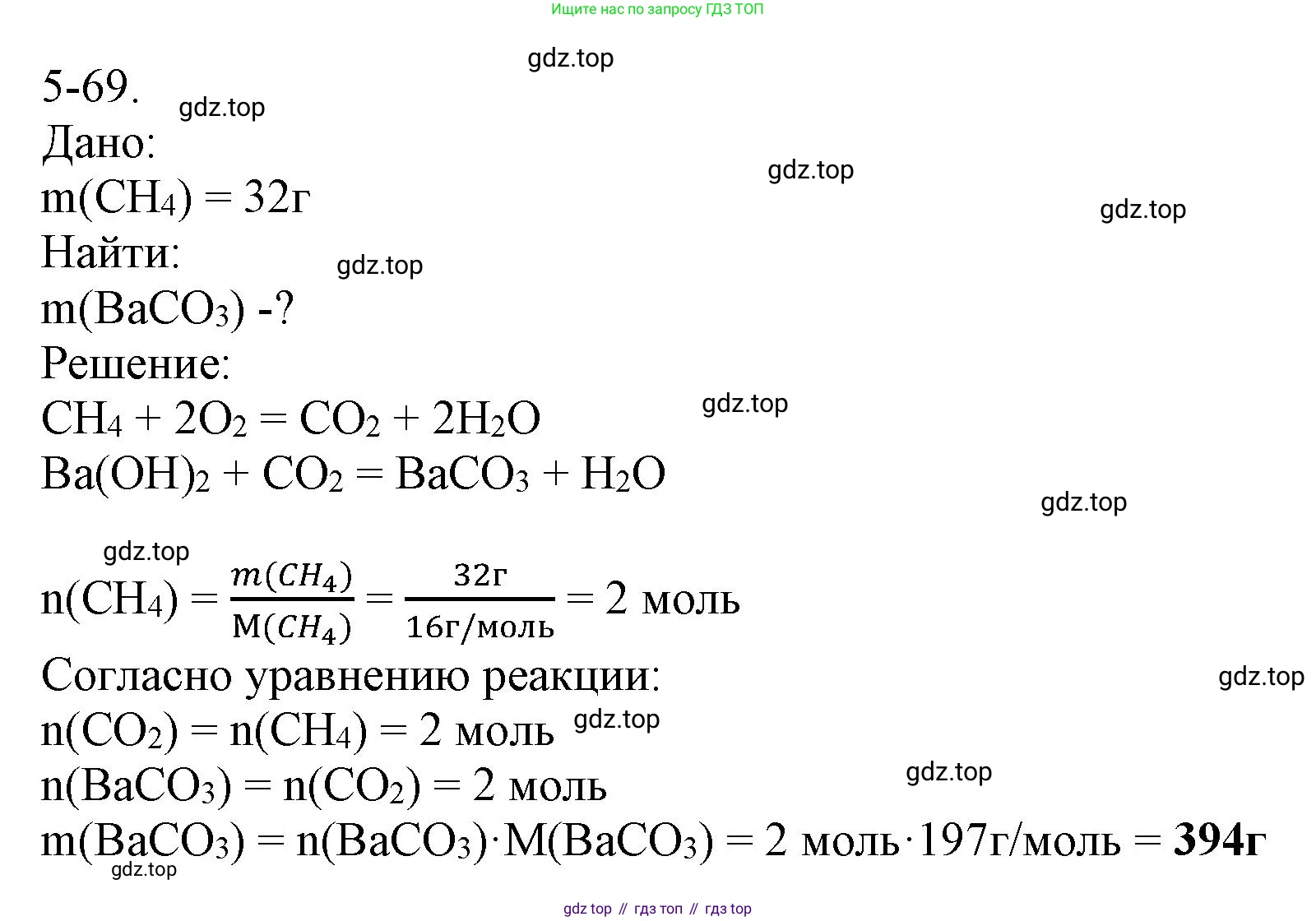
Дано:
$m(\text{CH}_4) = 32 \text{ г}$
$m(\text{CH}_4) = 0.032 \text{ кг}$
Найти:
$m(\text{BaCO}_3) - ?$
Решение:
Процесс состоит из двух последовательных химических реакций. Сначала происходит полное сгорание метана, в результате чего образуется углекислый газ. Затем этот газ реагирует с гидроксидом бария, образуя нерастворимый карбонат бария.
1. Составим уравнение реакции горения метана ($\text{CH}_4$):
$\text{CH}_4 + 2\text{O}_2 \rightarrow \text{CO}_2 + 2\text{H}_2\text{O}$
Из уравнения видно, что при сгорании 1 моль метана образуется 1 моль углекислого газа ($\text{CO}_2$).
2. Составим уравнение реакции взаимодействия углекислого газа с гидроксидом бария ($\text{Ba(OH)}_2$):
$\text{CO}_2 + \text{Ba(OH)}_2 \rightarrow \text{BaCO}_3\downarrow + \text{H}_2\text{O}$
Из этого уравнения следует, что из 1 моль углекислого газа образуется 1 моль карбоната бария ($\text{BaCO}_3$).
3. Рассчитаем молярные массы метана и карбоната бария, используя относительные атомные массы элементов: $Ar(\text{C}) = 12$, $Ar(\text{H}) = 1$, $Ar(\text{Ba}) = 137$, $Ar(\text{O}) = 16$.
Молярная масса метана: $M(\text{CH}_4) = 12 + 4 \cdot 1 = 16 \text{ г/моль}$
Молярная масса карбоната бария: $M(\text{BaCO}_3) = 137 + 12 + 3 \cdot 16 = 137 + 12 + 48 = 197 \text{ г/моль}$
4. Найдем количество вещества (число молей) метана массой 32 г:
$n(\text{CH}_4) = \frac{m(\text{CH}_4)}{M(\text{CH}_4)} = \frac{32 \text{ г}}{16 \text{ г/моль}} = 2 \text{ моль}$
5. Согласно стехиометрическим коэффициентам в первом уравнении, количество вещества образовавшегося углекислого газа равно количеству вещества сгоревшего метана:
$n(\text{CO}_2) = n(\text{CH}_4) = 2 \text{ моль}$
6. Согласно стехиометрическим коэффициентам во втором уравнении, количество вещества образовавшегося карбоната бария равно количеству вещества прореагировавшего углекислого газа (предполагая, что гидроксид бария был в избытке):
$n(\text{BaCO}_3) = n(\text{CO}_2) = 2 \text{ моль}$
7. Теперь вычислим массу образовавшегося карбоната бария:
$m(\text{BaCO}_3) = n(\text{BaCO}_3) \cdot M(\text{BaCO}_3) = 2 \text{ моль} \cdot 197 \text{ г/моль} = 394 \text{ г}$
Ответ: масса образовавшегося карбоната бария равна 394 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 5-69 расположенного на странице 59 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5-69 (с. 59), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.















