Лабораторный опыт, страница 79 - гдз по химии 8 класс учебник Рудзитис

Авторы: Рудзитис Г. Е.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2022
ISBN: 978-5-09-088251-4
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 8 классе
Глава 2. Кислород. Горение. Параграф 23. Свойства кислорода. Подумай, ответь, выполни... - страница 79.
Лабораторный опыт (с. 79)
Условие. Лабораторный опыт (с. 79)
скриншот условия
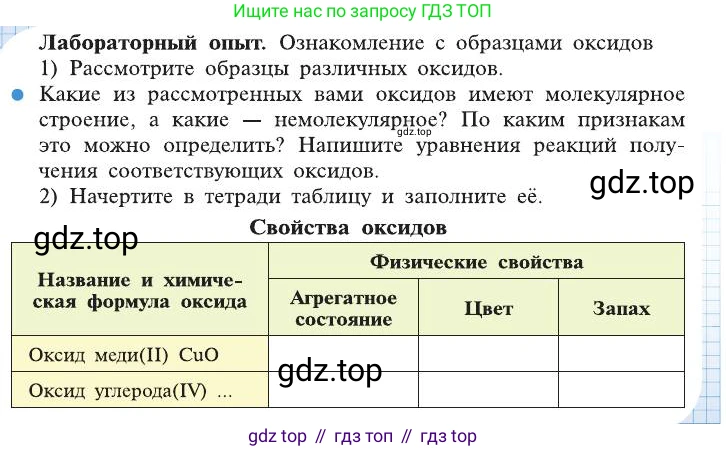
Лабораторный опыт. Ознакомление с образцами оксидов
1) Рассмотрите образцы различных оксидов.
🔵 Какие из рассмотренных вами оксидов имеют молекулярное строение, а какие — немолекулярное? По каким признакам это можно определить? Напишите уравнения реакций получения соответствующих оксидов.
2) Начертите в тетради таблицу и заполните её.
Свойства оксидов
Название и химическая формула оксида
Физические свойства
Агрегатное состояние
Цвет
Запах
Оксид меди(II) $CuO$
Оксид углерода(IV) ...
Решение. Лабораторный опыт (с. 79)

Решение 2. Лабораторный опыт (с. 79)
1) Решение:
В рамках данного опыта рассматриваются оксид меди(II) ($CuO$) и оксид углерода(IV) ($CO₂$).
Оксид углерода(IV) ($CO₂$) имеет молекулярное строение, а оксид меди(II) ($CuO$) — немолекулярное строение.
Определить тип строения можно по следующим признакам:
1. Тип химической связи. Тип строения вещества (кристаллической решетки) напрямую зависит от типа химической связи между частицами. В оксиде меди(II) связь ионная, так как она образована атомами металла ($\text{Cu}$) и неметалла ($\text{O}$). Вещества с ионной связью образуют ионные кристаллические решетки, которые относятся к немолекулярному типу строения. В оксиде углерода(IV) связь ковалентная полярная, так как она образована атомами двух неметаллов ($\text{C}$ и $\text{O}$). Вещества с ковалентными связями, которые существуют в виде отдельных молекул, образуют молекулярные кристаллические решетки.
2. Физические свойства. Вещества с немолекулярным строением (ионные, атомные) обычно являются твердыми, тугоплавкими и нелетучими веществами при нормальных условиях. Оксид меди(II) — это твердый порошок черного цвета с очень высокой температурой плавления (1326 °C). Вещества с молекулярным строением, напротив, имеют низкие температуры плавления и кипения. Оксид углерода(IV) (углекислый газ) при нормальных условиях является газом, что однозначно указывает на его молекулярное строение.
Уравнения реакций получения соответствующих оксидов:
- Получение оксида меди(II) при нагревании меди на воздухе:
$2Cu + O₂ \xrightarrow{t} 2CuO$
- Получение оксида углерода(IV) при сгорании угля (углерода):
$C + O₂ \xrightarrow{t} CO₂$
Ответ: Оксид углерода(IV) ($CO₂$) имеет молекулярное строение, а оксид меди(II) ($CuO$) — немолекулярное. Это определяется по типу химической связи (ковалентная в $CO₂$ и ионная в $CuO$) и агрегатному состоянию при н.у. (газ для $CO₂$ и твердое вещество для $CuO$). Уравнения получения: $C + O₂ \xrightarrow{t} CO₂$; $2Cu + O₂ \xrightarrow{t} 2CuO$.
2) Решение:
| Название и химическая формула оксида | Физические свойства | ||
|---|---|---|---|
| Агрегатное состояние | Цвет | Запах | |
| Оксид меди(II) $CuO$ | твердое | черный | без запаха |
| Оксид углерода(IV) $CO₂$ | газообразное | бесцветный | без запаха |
Ответ: Заполненная таблица представлена выше.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения Лабораторный опыт расположенного на странице 79 к учебнику 2019 - 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Лабораторный опыт (с. 79), автора: Рудзитис (Гунтис Екабович), ФГОС (старый) учебного пособия издательства Просвещение.














