Номер 6, страница 80 - гдз по химии 8 класс учебник Рудзитис

Авторы: Рудзитис Г. Е.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2022
ISBN: 978-5-09-088251-4
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 8 классе
Глава 2. Кислород. Горение. Параграф 23. Свойства кислорода. Подумай, ответь, выполни... - номер 6, страница 80.
№6 (с. 80)
Условие. №6 (с. 80)
скриншот условия

6. Составьте уравнения реакций, протекающих при горении:
а) фосфора;
б) алюминия.
Решение. №6 (с. 80)
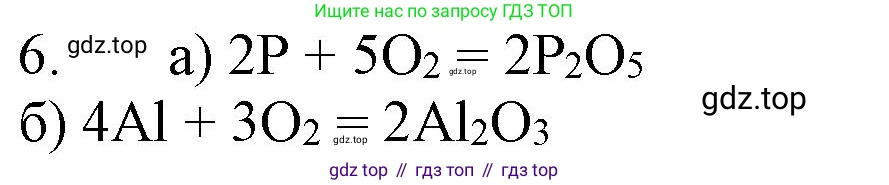
Решение 2. №6 (с. 80)
Решение
а) фосфора
Горение фосфора представляет собой его взаимодействие с кислородом. При сжигании фосфора в избытке кислорода образуется его высший оксид — оксид фосфора(V), химическая формула которого $P_2O_5$.
Запишем схему реакции и уравняем её, чтобы число атомов каждого элемента в левой и правой частях было одинаковым.
Схема реакции: $P + O_2 \rightarrow P_2O_5$.
1. Уравняем количество атомов кислорода. В продуктах 5 атомов, а в реагентах 2. Наименьшее общее кратное для 2 и 5 равно 10. Поставим коэффициент 5 перед $O_2$ и 2 перед $P_2O_5$:
$P + 5O_2 \rightarrow 2P_2O_5$
2. Теперь в правой части $2 \times 2 = 4$ атома фосфора. Чтобы уравнять количество атомов фосфора, поставим коэффициент 4 перед $\text{P}$ в левой части:
$4P + 5O_2 \rightarrow 2P_2O_5$
3. Проверим баланс атомов: слева 4 атома фосфора и $5 \times 2 = 10$ атомов кислорода; справа $2 \times 2 = 4$ атома фосфора и $2 \times 5 = 10$ атомов кислорода. Уравнение сбалансировано.
Ответ: $4P + 5O_2 \rightarrow 2P_2O_5$
б) алюминия
Алюминий — это активный металл, который при горении взаимодействует с кислородом воздуха. В результате реакции образуется твёрдый оксид алюминия, химическая формула которого $Al_2O_3$.
Запишем схему реакции и подберём коэффициенты.
Схема реакции: $Al + O_2 \rightarrow Al_2O_3$.
1. Уравняем количество атомов кислорода. В правой части 3 атома, а в левой 2. Наименьшее общее кратное для 2 и 3 равно 6. Поставим коэффициент 3 перед $O_2$ и 2 перед $Al_2O_3$:
$Al + 3O_2 \rightarrow 2Al_2O_3$
2. Теперь в правой части $2 \times 2 = 4$ атома алюминия. Для уравнивания поставим коэффициент 4 перед $\text{Al}$ в левой части:
$4Al + 3O_2 \rightarrow 2Al_2O_3$
3. Проверим баланс атомов: слева 4 атома алюминия и $3 \times 2 = 6$ атомов кислорода; справа $2 \times 2 = 4$ атома алюминия и $2 \times 3 = 6$ атомов кислорода. Уравнение сбалансировано.
Ответ: $4Al + 3O_2 \rightarrow 2Al_2O_3$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6 расположенного на странице 80 к учебнику 2019 - 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 80), автора: Рудзитис (Гунтис Екабович), ФГОС (старый) учебного пособия издательства Просвещение.














