Номер 4, страница 83 - гдз по химии 8 класс учебник Рудзитис

Авторы: Рудзитис Г. Е.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2022
ISBN: 978-5-09-088251-4
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 8 классе
Глава 2. Кислород. Горение. Параграф 24. Применение кислорода. Круговорот кислорода в природе. Подумай, ответь, выполни... - номер 4, страница 83.
№4 (с. 83)
Условие. №4 (с. 83)
скриншот условия

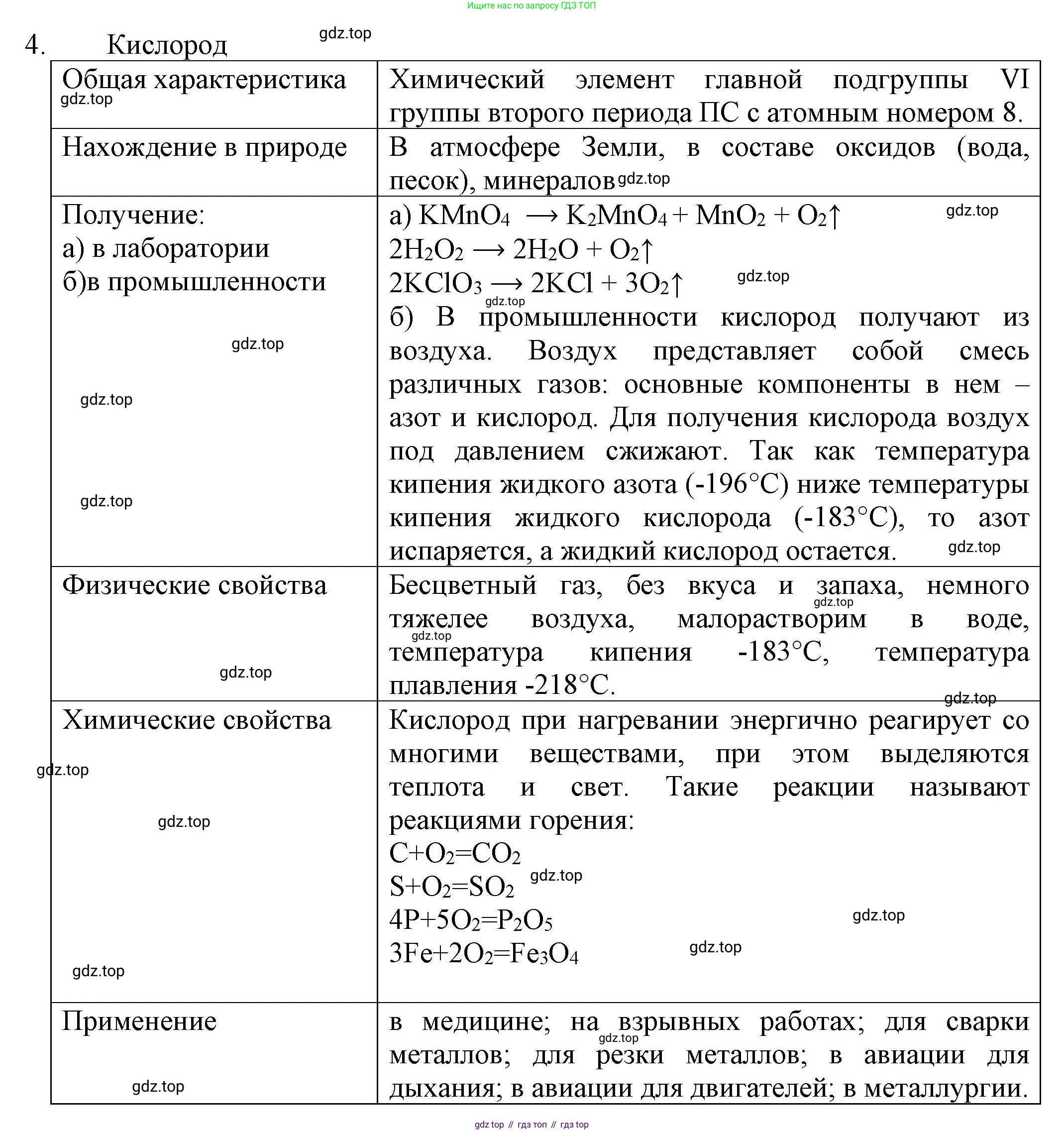
4. Обобщите знания о кислороде по плану, который представлен в таблице. Данную таблицу подготовьте с помощью компьютера и заполните её. Проверьте заполненную таблицу у соседа по парте.
Кислород
Общая характеристика
Нахождение в природе
Получение:
а) в лаборатории
б) в промышленности
Физические свойства
Химические свойства
Применение
Решение. №4 (с. 83)
Решение 2. №4 (с. 83)
Общая характеристика
Химический элемент с символом $\text{O}$ и атомным номером 8. Расположен во 2-м периоде, 16-й группе периодической таблицы. Является халькогеном и активным неметаллом. Относительная атомная масса около 16. Электронная конфигурация $1s^22s^22p^4$. Как простое вещество существует в виде двух аллотропных модификаций: кислород ($O_2$) и озон ($O_3$). Наиболее распространённая степень окисления –2. Ответ: Кислород (O) — это химический элемент 16-й группы, 2-го периода с атомным номером 8, активный неметалл-халькоген.
Нахождение в природе
Самый распространённый химический элемент на Земле по массе. Составляет около 47% массы земной коры (в составе оксидов, силикатов), 89% массы воды и 21% объёма атмосферы (в виде простого вещества $O_2$). Является ключевым элементом органических соединений и живых организмов. В стратосфере образует озоновый слой ($O_3$). Ответ: Кислород является самым распространенным элементом на Земле, встречаясь как в свободном виде в атмосфере, так и в связанном виде в составе воды, минералов и живых организмов.
Получение: а) в лаборатории б) в промышленности
В лабораторных условиях кислород получают разложением кислородсодержащих соединений: перманганата калия ($2KMnO_4 \xrightarrow{t} K_2MnO_4 + MnO_2 + O_2\uparrow$), хлората калия ($2KClO_3 \xrightarrow{t, MnO_2} 2KCl + 3O_2\uparrow$) или пероксида водорода ($2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2\uparrow$). В промышленности кислород получают главным образом фракционной перегонкой сжиженного воздуха, а также электролизом воды. Ответ: В лаборатории кислород получают разложением веществ, богатых кислородом (например, $KMnO_4$, $H_2O_2$), а в промышленности — из сжиженного воздуха методом ректификации.
Физические свойства
Кислород ($O_2$) при нормальных условиях — это газ без цвета, вкуса и запаха. Он немного тяжелее воздуха. Малорастворим в воде (растворимость составляет около 31 мл/л при 20°C). Температура кипения -183°C, температура плавления -218,8°C. Жидкий кислород имеет бледно-голубой цвет и является парамагнетиком. Ответ: Кислород — бесцветный газ без запаха, малорастворимый в воде, немного тяжелее воздуха, сжижается при -183°C, образуя жидкость голубого цвета.
Химические свойства
Кислород — сильный окислитель, по электроотрицательности уступает только фтору. Он активно реагирует со многими простыми и сложными веществами, обычно с выделением тепла и света (горение). Образует оксиды с большинством химических элементов. Примеры реакций: взаимодействие с металлами ($2Mg + O_2 \rightarrow 2MgO$), с неметаллами ($C + O_2 \xrightarrow{t} CO_2$), горение органических соединений ($CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O$). Не реагирует напрямую с галогенами, благородными металлами и инертными газами. Ответ: Кислород является химически активным веществом, сильным окислителем, поддерживающим горение и вступающим в реакции со многими веществами с образованием оксидов.
Применение
Кислород незаменим для процессов дыхания живых организмов, поэтому широко используется в медицине. В промышленности его применяют в металлургии для интенсификации процессов выплавки чугуна и стали, для газопламенной сварки и резки металлов. Жидкий кислород используется как окислитель в ракетных двигателях. Также кислород находит применение в химическом синтезе (например, для получения оксидов, кислот) и для очистки сточных вод. Ответ: Кислород применяется в медицине (дыхание), металлургии (выплавка металлов), для сварки и резки, как ракетный окислитель и в химической промышленности.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4 расположенного на странице 83 к учебнику 2019 - 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 83), автора: Рудзитис (Гунтис Екабович), ФГОС (старый) учебного пособия издательства Просвещение.















