Номер 2, страница 198 - гдз по химии 8 класс учебник Рудзитис

Авторы: Рудзитис Г. Е.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2022
ISBN: 978-5-09-088251-4
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 8 классе
Глава 8. Строение вещества. Химическая связь. Параграф 56. Основные виды химической связи. Подумай, ответь, выполни... - номер 2, страница 198.
№2 (с. 198)
Условие. №2 (с. 198)
скриншот условия

2. В тетрадях напишите по три формулы соединений:
а) с ионной;
б) с ковалентной полярной;
в) с ковалентной неполярной связью.
Изобразите их электронные формулы.
Решение. №2 (с. 198)
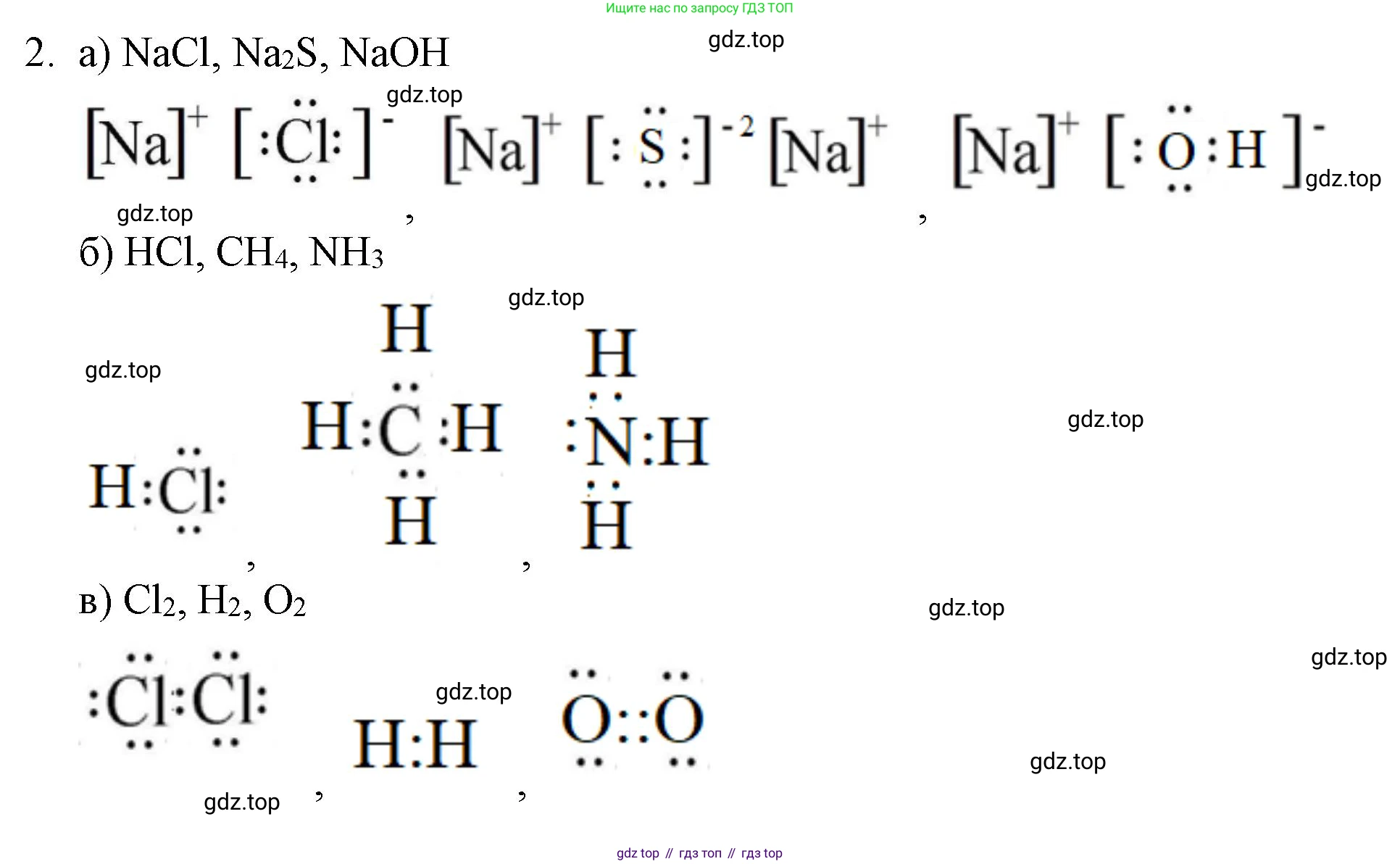
Решение 2. №2 (с. 198)
а) с ионной связью
Ионная связь образуется между атомами типичных металлов и типичных неметаллов. В результате взаимодействия атом металла отдает свои валентные электроны атому неметалла, превращаясь в положительно заряженный ион (катион), а атом неметалла, принимая электроны, становится отрицательно заряженным ионом (анионом). Связь между этими ионами осуществляется за счет электростатического притяжения. Разница в электроотрицательности (ЭО) между атомами, как правило, превышает 1.7.
1. Хлорид натрия ($NaCl$)
Атом натрия ($\text{Na}$), имеющий 1 валентный электрон, отдает его атому хлора ($\text{Cl}$), у которого 7 валентных электронов. Образуются ионы $Na^{+}$ и $Cl^{-}$.
Электронная формула: $Na^{+}[:\ddot{Cl}:]^{-}$
2. Оксид магния ($MgO$)
Атом магния ($\text{Mg}$), имеющий 2 валентных электрона, отдает их атому кислорода ($\text{O}$), у которого 6 валентных электронов. Образуются ионы $Mg^{2+}$ и $O^{2-}$.
Электронная формула: $Mg^{2+}[:\ddot{O}:]^{2-}$
3. Фторид кальция ($CaF_2$)
Атом кальция ($\text{Ca}$), имеющий 2 валентных электрона, отдает по одному электрону двум атомам фтора ($\text{F}$), у каждого из которых по 7 валентных электронов. Образуются ион $Ca^{2+}$ и два иона $F^{-}$.
Электронная формула: $Ca^{2+}2[:\ddot{F}:]^{-}$
Ответ: Три формулы соединений с ионной связью: $NaCl$, $MgO$, $CaF_2$. Их электронные формулы: $Na^{+}[:\ddot{Cl}:]^{-}$, $Mg^{2+}[:\ddot{O}:]^{2-}$, $Ca^{2+}2[:\ddot{F}:]^{-}$.
б) с ковалентной полярной связью
Ковалентная полярная связь образуется между атомами разных неметаллов за счет образования общих электронных пар. Из-за разной электроотрицательности атомов (разница ЭО от 0.4 до 1.7), общая электронная пара смещается в сторону более электроотрицательного атома, создавая на нем частичный отрицательный заряд ($δ^{-}$), а на другом — частичный положительный заряд ($δ^{+}$).
1. Хлороводород ($HCl$)
Связь образована одним атомом водорода ($\text{H}$) и одним атомом хлора ($\text{Cl}$). Общая электронная пара смещена к более электроотрицательному хлору.
Электронная формула: $H:\ddot{Cl}:$
2. Вода ($H_2O$)
Молекула состоит из одного атома кислорода ($\text{O}$) и двух атомов водорода ($\text{H}$). Две общие электронные пары смещены к более электроотрицательному кислороду.
Электронная формула: $H:\ddot{O}:H$
3. Аммиак ($NH_3$)
Молекула состоит из одного атома азота ($\text{N}$) и трех атомов водорода ($\text{H}$). Три общие электронные пары смещены к более электроотрицательному азоту.
Электронная формула: $H:\underset{\Large H}{\stackrel{\Large \ddot{}}{N}}:H$
Ответ: Три формулы соединений с ковалентной полярной связью: $HCl$, $H_2O$, $NH_3$. Их электронные формулы: $H:\ddot{Cl}:$, $H:\ddot{O}:H$, $H:\underset{\Large H}{\stackrel{\Large \ddot{}}{N}}:H$.
в) с ковалентной неполярной связью
Ковалентная неполярная связь образуется между атомами одного и того же химического элемента-неметалла (или элементов с очень близкой ЭО, разница < 0.4). В этом случае общая электронная пара располагается симметрично относительно ядер обоих атомов, и смещения электронной плотности не происходит.
1. Водород ($H_2$)
Молекула образована двумя атомами водорода ($\text{H}$) с одинаковой электроотрицательностью.
Электронная формула: $H:H$
2. Кислород ($O_2$)
Молекула образована двумя атомами кислорода ($\text{O}$), связанными двойной связью (двумя общими электронными парами).
Электронная формула: $:\ddot{O}::\ddot{O}:$
3. Азот ($N_2$)
Молекула образована двумя атомами азота ($\text{N}$), связанными тройной связью (тремя общими электронными парами).
Электронная формула: $:N:::N:$
Ответ: Три формулы соединений с ковалентной неполярной связью: $H_2$, $O_2$, $N_2$. Их электронные формулы: $H:H$, $:\ddot{O}::\ddot{O}:$, $:N:::N:$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2 расположенного на странице 198 к учебнику 2019 - 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 198), автора: Рудзитис (Гунтис Екабович), ФГОС (старый) учебного пособия издательства Просвещение.















