Номер 4, страница 169 - гдз по химии 8 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: синий, зелёный
ISBN: 978-5-09-105831-4
Популярные ГДЗ в 8 классе
Глава VI. Важнейшие классы неорганических соединений. Параграф 47. Классификация и получение солей. Подумай, ответь, выполни - номер 4, страница 169.
№4 (с. 169)
Условие 2023. №4 (с. 169)
скриншот условия

4. Перечислите все способы, с помощью которых можно получить сульфат бария. Напишите уравнения соответствующих реакций.
Решение 2023. №4 (с. 169)
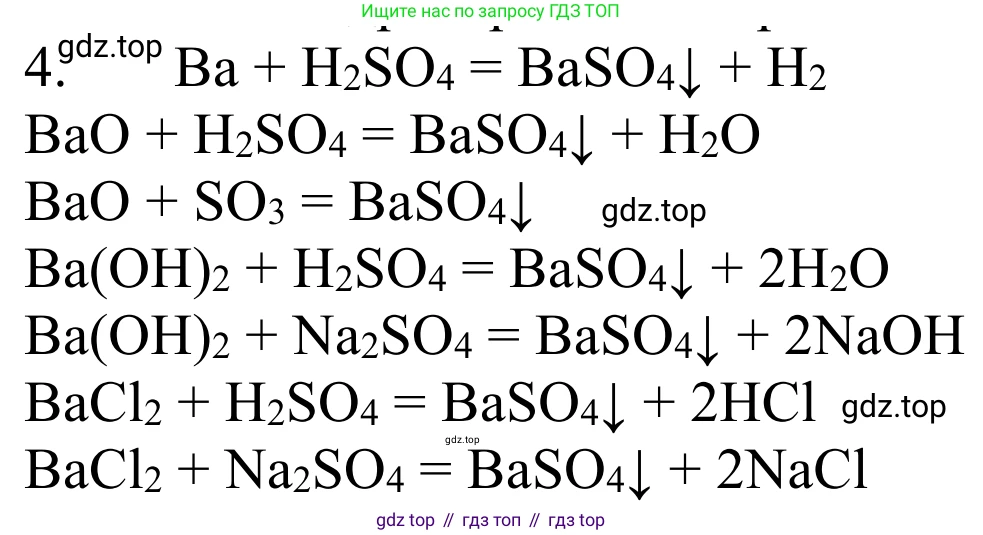
Решение 2. №4 (с. 169)
Сульфат бария ($BaSO_4$) — это нерастворимая в воде соль, которую можно получить несколькими способами, в основном основанными на реакциях ионного обмена, где ионы бария ($Ba^{2+}$) и сульфат-ионы ($SO_4^{2-}$) встречаются в растворе, или на реакциях, где атом серы окисляется до степени окисления +6 в присутствии бария.
1. Взаимодействие растворимой соли бария с растворимым сульфатом (реакция ионного обмена)
Это наиболее распространенный лабораторный способ. При сливании растворов, содержащих ионы $Ba^{2+}$ и $SO_4^{2-}$, выпадает белый мелкокристаллический осадок сульфата бария. В качестве соли бария можно использовать хлорид ($BaCl_2$) или нитрат ($Ba(NO_3)_2$), а в качестве сульфата — сульфат натрия ($Na_2SO_4$), калия ($K_2SO_4$) или меди(II) ($CuSO_4$).
$BaCl_2 + Na_2SO_4 \rightarrow BaSO_4\downarrow + 2NaCl$
Ответ: $BaCl_2 + Na_2SO_4 \rightarrow BaSO_4\downarrow + 2NaCl$
2. Взаимодействие основания с кислотой (реакция нейтрализации)
Сульфат бария образуется при реакции между гидроксидом бария (щёлочью) и серной кислотой. В результате реакции обмена выпадает нерастворимый осадок сульфата бария и образуется вода.
$Ba(OH)_2 + H_2SO_4 \rightarrow BaSO_4\downarrow + 2H_2O$
Ответ: $Ba(OH)_2 + H_2SO_4 \rightarrow BaSO_4\downarrow + 2H_2O$
3. Взаимодействие соли бария с серной кислотой
При добавлении серной кислоты к раствору любой растворимой соли бария образуется осадок $BaSO_4$.
$Ba(NO_3)_2 + H_2SO_4 \rightarrow BaSO_4\downarrow + 2HNO_3$
Серная кислота, как более сильная, также может вытеснять более слабые летучие кислоты из их солей, например, угольную кислоту из карбоната бария (который нерастворим в воде, но реагирует с сильными кислотами).
$BaCO_3 + H_2SO_4 \rightarrow BaSO_4\downarrow + H_2O + CO_2\uparrow$
Ответ: $Ba(NO_3)_2 + H_2SO_4 \rightarrow BaSO_4\downarrow + 2HNO_3$
4. Взаимодействие основного оксида с кислотой
Оксид бария ($BaO$) как основный оксид реагирует с серной кислотой с образованием соли и воды.
$BaO + H_2SO_4 \rightarrow BaSO_4\downarrow + H_2O$
Ответ: $BaO + H_2SO_4 \rightarrow BaSO_4\downarrow + H_2O$
5. Взаимодействие металла с кислотой
Активный металл барий реагирует с серной кислотой, замещая в ней водород. Образующийся сульфат бария нерастворим и покрывает поверхность металла, что может замедлить или остановить реакцию.
$Ba + H_2SO_4 \rightarrow BaSO_4\downarrow + H_2\uparrow$
Ответ: $Ba + H_2SO_4 \rightarrow BaSO_4\downarrow + H_2\uparrow$
6. Взаимодействие основного оксида с кислотным оксидом
Сульфат бария может быть получен прямым синтезом из оксида бария ($BaO$) и оксида серы(VI) ($SO_3$).
$BaO + SO_3 \rightarrow BaSO_4$
Ответ: $BaO + SO_3 \rightarrow BaSO_4$
7. Взаимодействие основания с кислотным оксидом
Гидроксид бария реагирует с оксидом серы(VI), образуя соль и воду.
$Ba(OH)_2 + SO_3 \rightarrow BaSO_4\downarrow + H_2O$
Ответ: $Ba(OH)_2 + SO_3 \rightarrow BaSO_4\downarrow + H_2O$
8. Окислительно-восстановительные реакции
Сульфат бария можно получить окислением соединений бария, где сера имеет более низкую степень окисления, например, сульфида бария ($BaS$).
Окисление кислородом при нагревании (обжиг):
$BaS + 2O_2 \xrightarrow{t^\circ} BaSO_4$
Окисление пероксидом водорода:
$BaS + 4H_2O_2 \rightarrow BaSO_4\downarrow + 4H_2O$
Ответ: $BaS + 2O_2 \xrightarrow{t^\circ} BaSO_4$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4 расположенного на странице 169 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 169), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.
















