Номер 11, страница 90 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 2. Химическая реакция. Параграф 16. Составление уравнений окислительно-восстановительных реакций. Вопросы и задания - номер 11, страница 90.
№11 (с. 90)
Условие. №11 (с. 90)
скриншот условия

11. Методом электронного баланса расставьте коэффициенты в следующих схемах реакций:
а) $BaSO_4 + C \rightarrow BaS + CO;$
$Al + H_2SO_4 \rightarrow Al_2(SO_4)_3 + H_2;$
$KClO_3 + P \rightarrow KCl + P_2O_5;$
$S + KOH \rightarrow K_2SO_3 + K_2S + H_2O;$
б) $KClO_3 \rightarrow KClO_4 + KCl;$
$Na_2CO_3 + C \rightarrow Na + CO.$
Решение. №11 (с. 90)
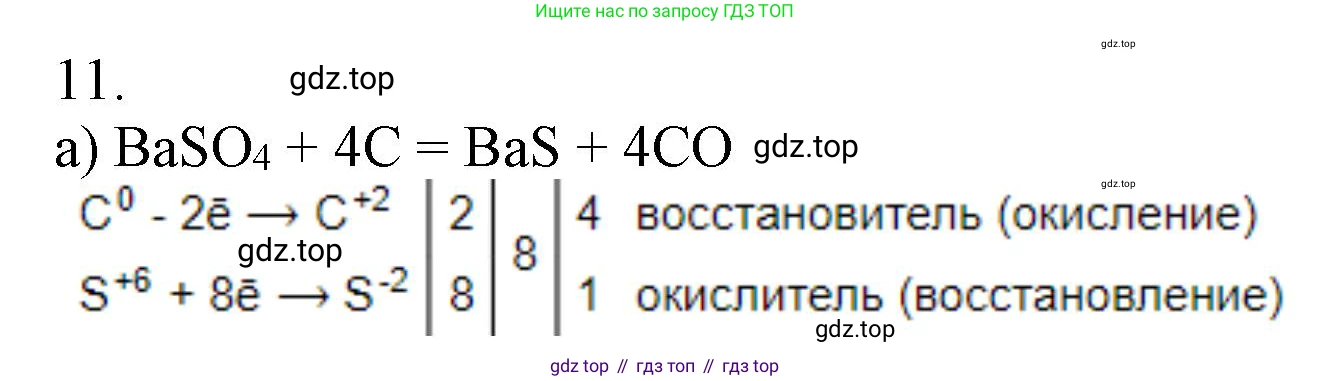

Решение 2. №11 (с. 90)
а) Для реакции BaSO₄ + C → BaS + CO:
Решение
1. Определяем степени окисления элементов до и после реакции:
$Ba^{+2}S^{+6}O_4^{-2} + C^0 \rightarrow Ba^{+2}S^{-2} + C^{+2}O^{-2}$
Изменяют степени окисления сера ($S$) и углерод ($C$).
2. Составляем электронный баланс:
$S^{+6} + 8e^{-} \rightarrow S^{-2}$ | 1 (процесс восстановления, $S^{+6}$ в $BaSO_4$ – окислитель)
$C^0 - 2e^{-} \rightarrow C^{+2}$ | 4 (процесс окисления, $C^0$ – восстановитель)
3. Наименьшее общее кратное для чисел электронов (8 и 2) равно 8. Домножаем полуреакции на соответствующие множители (1 и 4).
Таким образом, коэффициент перед соединениями серы ($BaSO_4$, $BaS$) равен 1, а перед углеродом и его соединением ($C$, $CO$) равен 4.
4. Расставляем коэффициенты в уравнении:
$BaSO_4 + 4C \rightarrow BaS + 4CO$
Проверяем баланс атомов: Ba(1=1), S(1=1), O(4=4), C(4=4). Уравнение сбалансировано.
Ответ:$BaSO_4 + 4C \rightarrow BaS + 4CO$.
Для реакции Al + H₂SO₄ → Al₂(SO₄)₃ + H₂:
Решение
1. Определяем степени окисления:
$Al^0 + H_2^{+1}S^{+6}O_4^{-2} \rightarrow Al_2^{+3}(S^{+6}O_4^{-2})_3 + H_2^0$
Изменяют степени окисления алюминий ($Al$) и водород ($H$).
2. Составляем электронный баланс:
$Al^0 - 3e^{-} \rightarrow Al^{+3}$ | 2 (процесс окисления, $Al^0$ – восстановитель)
$2H^{+1} + 2e^{-} \rightarrow H_2^0$ | 3 (процесс восстановления, $H^{+1}$ в $H_2SO_4$ – окислитель)
3. НОК для чисел электронов (3 и 2) равно 6. Множители – 2 и 3.
Коэффициент перед $Al$ ставим 2. Коэффициент перед $H_2$ ставим 3.
4. Расставляем коэффициенты в уравнении:
$2Al + H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2$
Теперь уравниваем остальные атомы. Алюминий уже сбалансирован ($2Al \rightarrow Al_2$). Для баланса сульфат-ионов ($SO_4^{2-}$) справа их 3, значит, слева перед $H_2SO_4$ нужен коэффициент 3.
$2Al + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2$
Проверяем баланс: Al(2=2), H(6=6), S(3=3), O(12=12). Уравнение сбалансировано.
Ответ:$2Al + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2$.
Для реакции KClO₃ + P → KCl + P₂O₅:
Решение
1. Определяем степени окисления:
$K^{+1}Cl^{+5}O_3^{-2} + P^0 \rightarrow K^{+1}Cl^{-1} + P_2^{+5}O_5^{-2}$
Изменяют степени окисления хлор ($Cl$) и фосфор ($P$).
2. Составляем электронный баланс. Учитываем, что в продукте образуется $P_2O_5$, поэтому в полуреакции окисления используем $2P$:
$Cl^{+5} + 6e^{-} \rightarrow Cl^{-1}$ | 5 (процесс восстановления, $Cl^{+5}$ в $KClO_3$ – окислитель)
$2P^0 - 10e^{-} \rightarrow P_2^{+5}$ | 3 (процесс окисления, $P^0$ – восстановитель)
3. НОК для чисел электронов (6 и 10) равно 30. Множители – 5 и 3.
Коэффициент 5 ставим перед соединениями хлора ($KClO_3$ и $KCl$).
Коэффициент 3 ставим перед $P_2O_5$. Так как в полуреакции участвовало $2P$, то перед простым веществом фосфором ставим коэффициент $3 \times 2 = 6$.
4. Расставляем коэффициенты в уравнении:
$5KClO_3 + 6P \rightarrow 5KCl + 3P_2O_5$
Проверяем баланс: K(5=5), Cl(5=5), O(15=15), P(6=6). Уравнение сбалансировано.
Ответ:$5KClO_3 + 6P \rightarrow 5KCl + 3P_2O_5$.
Для реакции S + KOH → K₂SO₃ + K₂S + H₂O:
Решение
1. Это реакция диспропорционирования. Сера одновременно и окисляется, и восстанавливается.
Определяем степени окисления:
$S^0 + K^{+1}O^{-2}H^{+1} \rightarrow K_2^{+1}S^{+4}O_3^{-2} + K_2^{+1}S^{-2} + H_2^{+1}O^{-2}$
2. Составляем электронный баланс для серы:
$S^0 - 4e^{-} \rightarrow S^{+4}$ | 1 (процесс окисления)
$S^0 + 2e^{-} \rightarrow S^{-2}$ | 2 (процесс восстановления)
3. НОК для чисел электронов (4 и 2) равно 4. Множители – 1 и 2.
Это означает, что на 1 атом серы, окислившийся до $+4$, приходится 2 атома серы, восстановившихся до $-2$. Всего в реакции участвует $1+2=3$ атома серы.
Ставим коэффициент 1 перед $K_2SO_3$ и 2 перед $K_2S$. Перед серой слева ставим их сумму – 3.
$3S + KOH \rightarrow 1K_2SO_3 + 2K_2S + H_2O$
4. Уравниваем остальные элементы. Справа атомов калия: $1 \times 2 + 2 \times 2 = 6$. Значит, слева перед $KOH$ ставим 6.
$3S + 6KOH \rightarrow K_2SO_3 + 2K_2S + H_2O$
Слева 6 атомов водорода, справа 2. Ставим коэффициент 3 перед $H_2O$.
$3S + 6KOH \rightarrow K_2SO_3 + 2K_2S + 3H_2O$
Проверяем кислород: слева 6, справа $3 + 3 = 6$. Уравнение сбалансировано.
Ответ:$3S + 6KOH \rightarrow K_2SO_3 + 2K_2S + 3H_2O$.
б) Для реакции KClO₃ → KClO₄ + KCl:
Решение
1. Это реакция диспропорционирования. Хлор одновременно и окисляется, и восстанавливается.
Определяем степени окисления:
$K^{+1}Cl^{+5}O_3^{-2} \rightarrow K^{+1}Cl^{+7}O_4^{-2} + K^{+1}Cl^{-1}$
2. Составляем электронный баланс для хлора:
$Cl^{+5} - 2e^{-} \rightarrow Cl^{+7}$ | 3 (процесс окисления)
$Cl^{+5} + 6e^{-} \rightarrow Cl^{-1}$ | 1 (процесс восстановления)
3. НОК для чисел электронов (2 и 6) равно 6. Множители – 3 и 1.
На 3 атома хлора, окислившихся до $+7$ (в $KClO_4$), приходится 1 атом хлора, восстановившийся до $-1$ (в $KCl$).
Всего в реакции участвует $3+1=4$ атома хлора. Ставим коэффициент 4 перед $KClO_3$.
Ставим 3 перед $KClO_4$ и 1 перед $KCl$.
4. Записываем уравнение с коэффициентами:
$4KClO_3 \rightarrow 3KClO_4 + KCl$
Проверяем баланс: K(4=3+1), Cl(4=3+1), O(12=12). Уравнение сбалансировано.
Ответ:$4KClO_3 \rightarrow 3KClO_4 + KCl$.
Для реакции Na₂CO₃ + C → Na + CO:
Решение
1. Определяем степени окисления:
$Na_2^{+1}C^{+4}O_3^{-2} + C^0 \rightarrow Na^0 + C^{+2}O^{-2}$
Восстанавливается натрий ($Na^{+1} \rightarrow Na^0$), окисляется углерод ($C^0 \rightarrow C^{+2}$). Углерод в карбонате натрия также меняет степень окисления ($C^{+4} \rightarrow C^{+2}$). Однако для простоты метода электронного баланса рассмотрим только основные процессы.
2. Составляем электронный баланс для основных участников:
$Na^{+1} + 1e^{-} \rightarrow Na^0$ | 2 (процесс восстановления, $Na^{+1}$ – окислитель)
$C^0 - 2e^{-} \rightarrow C^{+2}$ | 1 (процесс окисления, $C^0$ – восстановитель)
3. НОК для чисел электронов (1 и 2) равно 2. Множители – 2 и 1.
Это означает, что на 2 атома натрия, которые восстанавливаются, приходится 1 атом углерода, который окисляется.
4. Используем это соотношение для расстановки коэффициентов. Возьмем 1 молекулу $Na_2CO_3$, в ней 2 атома $Na$. Тогда нам понадобится 2 атома $C^0$ (т.к. карбонат-ион тоже разлагается, и одного атома $C^0$ не хватит для баланса). В продуктах получим 2 атома $Na$.
$Na_2CO_3 + xC \rightarrow 2Na + yCO$
Теперь уравняем атомы углерода и кислорода. Слева 3 атома кислорода. Чтобы их уравнять, справа перед $CO$ нужно поставить коэффициент 3.
$Na_2CO_3 + xC \rightarrow 2Na + 3CO$
Теперь считаем углерод. Справа 3 атома, слева 1 в $Na_2CO_3$. Значит, $x=2$.
$Na_2CO_3 + 2C \rightarrow 2Na + 3CO$
Проверяем баланс: Na(2=2), C(1+2=3), O(3=3). Уравнение сбалансировано.
Ответ:$Na_2CO_3 + 2C \rightarrow 2Na + 3CO$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 11 расположенного на странице 90 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №11 (с. 90), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















