Номер 4, страница 90 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 2. Химическая реакция. Параграф 16. Составление уравнений окислительно-восстановительных реакций. Вопросы и задания - номер 4, страница 90.
№4 (с. 90)
Условие. №4 (с. 90)
скриншот условия
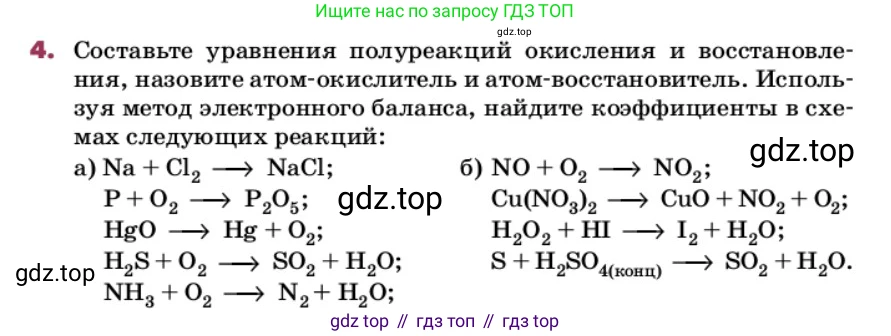
4. Составьте уравнения полуреакций окисления и восстановления, назовите атом-окислитель и атом-восстановитель. Используя метод электронного баланса, найдите коэффициенты в схемах следующих реакций:
а) $Na + Cl_2 \rightarrow NaCl;$
$P + O_2 \rightarrow P_2O_5;$
$HgO \rightarrow Hg + O_2;$
$H_2S + O_2 \rightarrow SO_2 + H_2O;$
$NH_3 + O_2 \rightarrow N_2 + H_2O;$
б) $NO + O_2 \rightarrow NO_2;$
$Cu(NO_3)_2 \rightarrow CuO + NO_2 + O_2;$
$H_2O_2 + HI \rightarrow I_2 + H_2O;$
$S + H_2SO_4(\text{конц}) \rightarrow SO_2 + H_2O.$
Решение. №4 (с. 90)
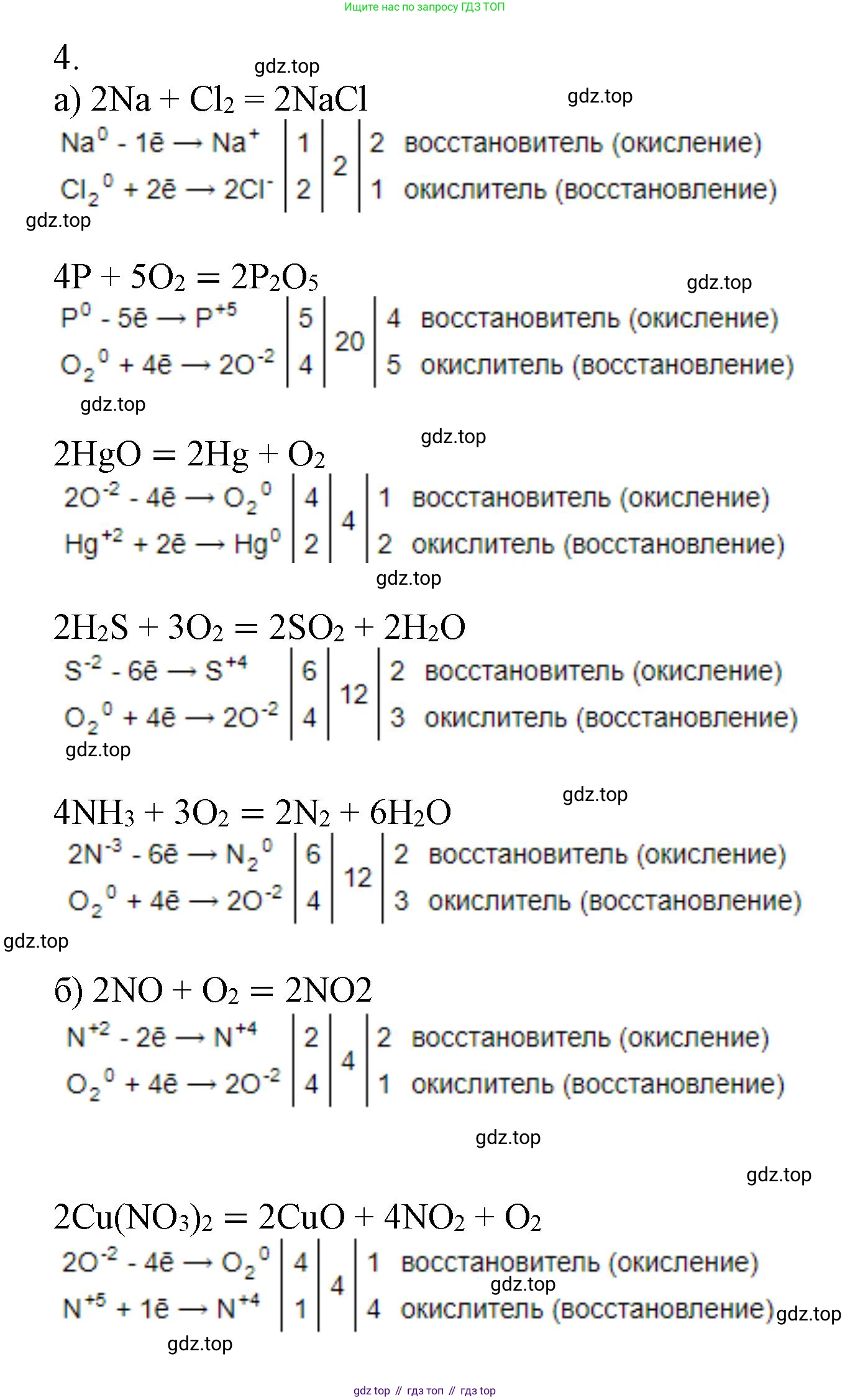

Решение 2. №4 (с. 90)
а) Реакция: $Na + Cl_2 \rightarrow NaCl$
Определим степени окисления элементов:
$Na^0 + Cl_2^0 \rightarrow Na^{+1}Cl^{-1}$
Натрий ($Na$) повышает свою степень окисления с 0 до +1, он отдает электрон, следовательно, является восстановителем (происходит процесс окисления).
Хлор ($Cl$) понижает свою степень окисления с 0 до -1, он принимает электроны, следовательно, является окислителем (происходит процесс восстановления).
Составим уравнения полуреакций (электронный баланс):
$Na^0 - 1e^- \rightarrow Na^{+1}$ | 2 | окисление
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ | 1 | восстановление
Атом-восстановитель: $Na$.
Атом-окислитель: $Cl$.
Ответ: $2Na + Cl_2 \rightarrow 2NaCl$.
Реакция: $P + O_2 \rightarrow P_2O_5$
Определим степени окисления элементов:
$P^0 + O_2^0 \rightarrow P_2^{+5}O_5^{-2}$
Фосфор ($P$) повышает свою степень окисления с 0 до +5, он отдает электроны, следовательно, является восстановителем (происходит процесс окисления).
Кислород ($O$) понижает свою степень окисления с 0 до -2, он принимает электроны, следовательно, является окислителем (происходит процесс восстановления).
Составим уравнения полуреакций (электронный баланс):
$P^0 - 5e^- \rightarrow P^{+5}$ | 4 | окисление
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 5 | восстановление
Атом-восстановитель: $P$.
Атом-окислитель: $O$.
Ответ: $4P + 5O_2 \rightarrow 2P_2O_5$.
Реакция: $HgO \rightarrow Hg + O_2$
Определим степени окисления элементов:
$Hg^{+2}O^{-2} \rightarrow Hg^0 + O_2^0$
Кислород ($O$) повышает свою степень окисления с -2 до 0, он отдает электроны, следовательно, является восстановителем (происходит процесс окисления).
Ртуть ($Hg$) понижает свою степень окисления с +2 до 0, она принимает электроны, следовательно, является окислителем (происходит процесс восстановления).
Составим уравнения полуреакций (электронный баланс):
$2O^{-2} - 4e^- \rightarrow O_2^0$ | 1 | окисление
$Hg^{+2} + 2e^- \rightarrow Hg^0$ | 2 | восстановление
Атом-восстановитель: $O$ (в составе $HgO$).
Атом-окислитель: $Hg$ (в составе $HgO$).
Ответ: $2HgO \rightarrow 2Hg + O_2$.
Реакция: $H_2S + O_2 \rightarrow SO_2 + H_2O$
Определим степени окисления элементов:
$H_2^{+1}S^{-2} + O_2^0 \rightarrow S^{+4}O_2^{-2} + H_2^{+1}O^{-2}$
Сера ($S$) повышает свою степень окисления с -2 до +4, она отдает электроны, следовательно, является восстановителем (в составе $H_2S$).
Кислород ($O$) понижает свою степень окисления с 0 до -2, он принимает электроны, следовательно, является окислителем.
Составим уравнения полуреакций (электронный баланс):
$S^{-2} - 6e^- \rightarrow S^{+4}$ | 2 | окисление
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 3 | восстановление
Атом-восстановитель: $S$ (в составе $H_2S$).
Атом-окислитель: $O$ (в составе $O_2$).
Ответ: $2H_2S + 3O_2 \rightarrow 2SO_2 + 2H_2O$.
Реакция: $NH_3 + O_2 \rightarrow N_2 + H_2O$
Определим степени окисления элементов:
$N^{-3}H_3^{+1} + O_2^0 \rightarrow N_2^0 + H_2^{+1}O^{-2}$
Азот ($N$) повышает свою степень окисления с -3 до 0, он отдает электроны, следовательно, является восстановителем (в составе $NH_3$).
Кислород ($O$) понижает свою степень окисления с 0 до -2, он принимает электроны, следовательно, является окислителем.
Составим уравнения полуреакций (электронный баланс):
$2N^{-3} - 6e^- \rightarrow N_2^0$ | 2 | окисление
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 3 | восстановление
Атом-восстановитель: $N$ (в составе $NH_3$).
Атом-окислитель: $O$ (в составе $O_2$).
Ответ: $4NH_3 + 3O_2 \rightarrow 2N_2 + 6H_2O$.
б) Реакция: $NO + O_2 \rightarrow NO_2$
Определим степени окисления элементов:
$N^{+2}O^{-2} + O_2^0 \rightarrow N^{+4}O_2^{-2}$
Азот ($N$) повышает свою степень окисления с +2 до +4, он отдает электроны, следовательно, является восстановителем (в составе $NO$).
Кислород ($O$) в простом веществе $O_2$ понижает свою степень окисления с 0 до -2, он принимает электроны, следовательно, является окислителем.
Составим уравнения полуреакций (электронный баланс):
$N^{+2} - 2e^- \rightarrow N^{+4}$ | 2 | окисление
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 1 | восстановление
Атом-восстановитель: $N$ (в составе $NO$).
Атом-окислитель: $O$ (в составе $O_2$).
Ответ: $2NO + O_2 \rightarrow 2NO_2$.
Реакция: $Cu(NO_3)_2 \rightarrow CuO + NO_2 + O_2$
Определим степени окисления элементов:
$Cu^{+2}(N^{+5}O_3^{-2})_2 \rightarrow Cu^{+2}O^{-2} + N^{+4}O_2^{-2} + O_2^0$
Кислород ($O$) повышает свою степень окисления с -2 (в нитрат-ионе) до 0, он отдает электроны, следовательно, является восстановителем.
Азот ($N$) понижает свою степень окисления с +5 до +4, он принимает электроны, следовательно, является окислителем.
Составим уравнения полуреакций (электронный баланс):
$2O^{-2} - 4e^- \rightarrow O_2^0$ | 1 | окисление
$N^{+5} + 1e^- \rightarrow N^{+4}$ | 4 | восстановление
Атом-восстановитель: $O$ (в составе $Cu(NO_3)_2$).
Атом-окислитель: $N$ (в составе $Cu(NO_3)_2$).
Ответ: $2Cu(NO_3)_2 \rightarrow 2CuO + 4NO_2 + O_2$.
Реакция: $H_2O_2 + HI \rightarrow I_2 + H_2O$
Определим степени окисления элементов:
$H_2^{+1}O_2^{-1} + H^{+1}I^{-1} \rightarrow I_2^0 + H_2^{+1}O^{-2}$
Йод ($I$) повышает свою степень окисления с -1 до 0, он отдает электроны, следовательно, является восстановителем (в составе $HI$).
Кислород ($O$) понижает свою степень окисления с -1 до -2, он принимает электроны, следовательно, является окислителем (в составе $H_2O_2$).
Составим уравнения полуреакций (электронный баланс):
$2I^{-1} - 2e^- \rightarrow I_2^0$ | 1 | окисление
$O_2^{-2} + 2e^- \rightarrow 2O^{-2}$ (или $2O^{-1} + 2e^- \rightarrow 2O^{-2}$) | 1 | восстановление
Атом-восстановитель: $I$ (в составе $HI$).
Атом-окислитель: $O$ (в составе $H_2O_2$).
Ответ: $H_2O_2 + 2HI \rightarrow I_2 + 2H_2O$.
Реакция: $S + H_2SO_4(конц) \rightarrow SO_2 + H_2O$
Определим степени окисления элементов:
$S^0 + H_2^{+1}S^{+6}O_4^{-2} \rightarrow S^{+4}O_2^{-2} + H_2^{+1}O^{-2}$
Элементарная сера ($S^0$) повышает свою степень окисления с 0 до +4, она отдает электроны, следовательно, является восстановителем.
Сера ($S$) в серной кислоте понижает свою степень окисления с +6 до +4, она принимает электроны, следовательно, является окислителем (в составе $H_2SO_4$).
Составим уравнения полуреакций (электронный баланс):
$S^0 - 4e^- \rightarrow S^{+4}$ | 1 | окисление
$S^{+6} + 2e^- \rightarrow S^{+4}$ | 2 | восстановление
Атом-восстановитель: $S^0$.
Атом-окислитель: $S^{+6}$ (в составе $H_2SO_4$).
Ответ: $S + 2H_2SO_4 \rightarrow 3SO_2 + 2H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 90 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 90), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















