Номер 6, страница 142 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2025
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 27. Серная кислота. Вопросы и задания - номер 6, страница 142.
№6 (с. 142)
Условие. №6 (с. 142)
скриншот условия

6. Сернистый газ можно получить взаимодействием концентрированной серной кислоты с ртутью. Напишите уравнение реакции, зная, что ртуть в образующейся соли двухвалентна.
Решение. №6 (с. 142)
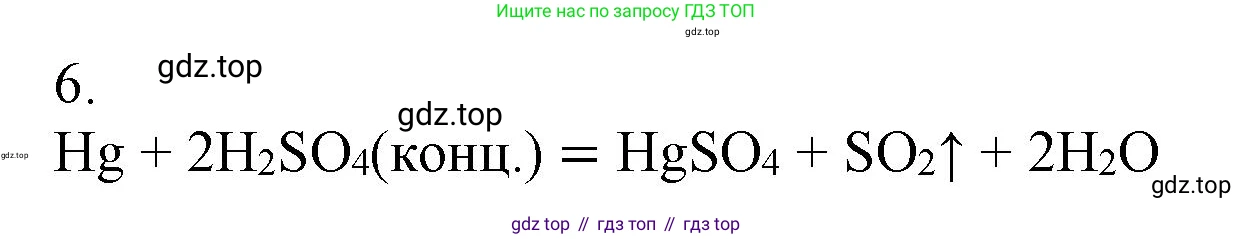
Решение 2. №6 (с. 142)
Решение
Взаимодействие ртути с концентрированной серной кислотой является окислительно-восстановительной реакцией. Ртуть ($Hg$) является металлом, стоящим в ряду активности после водорода, поэтому она не реагирует с разбавленными кислотами. Однако концентрированная серная кислота ($H_2SO_4$) является сильным окислителем за счет серы в высшей степени окисления $+6$ и способна окислять малоактивные металлы, такие как ртуть.
В ходе реакции образуются:
- Сернистый газ (диоксид серы, $SO_2$) — продукт восстановления серы.
- Соль, в которой ртуть, согласно условию, двухвалентна ($Hg^{2+}$). Сульфат-ион ($SO_4^{2-}$) имеет заряд -2, поэтому формула соли — сульфат ртути(II), $HgSO_4$.
- Вода ($H_2O$).
Запишем схему реакции:
$Hg + H_2SO_4 \text{(конц.)} \rightarrow HgSO_4 + SO_2 + H_2O$
Для расстановки коэффициентов используем метод электронного баланса. Определим степени окисления элементов, которые их изменяют в ходе реакции:
$ \stackrel{0}{Hg} + H_2\stackrel{+6}{S}O_4 \rightarrow \stackrel{+2}{Hg}\stackrel{+6}{S}O_4 + \stackrel{+4}{S}O_2 + H_2O $
Составим полуреакции окисления и восстановления:
$Hg^0 - 2e^- \rightarrow Hg^{+2}$ | 1 (процесс окисления, $Hg$ — восстановитель)
$S^{+6} + 2e^- \rightarrow S^{+4}$ | 1 (процесс восстановления, $H_2SO_4$ — окислитель)
Количество отданных электронов равно количеству принятых, поэтому стехиометрические коэффициенты перед соединениями, содержащими $Hg^0$ и $S^{+4}$, равны 1.
$1 \cdot Hg + H_2SO_4 \rightarrow 1 \cdot HgSO_4 + 1 \cdot SO_2 + H_2O$
Теперь уравняем количество атомов серы. В правой части уравнения находится 1 атом серы в сульфате ртути ($HgSO_4$) и 1 атом серы в диоксиде серы ($SO_2$), всего 2 атома. Следовательно, в левой части перед $H_2SO_4$ необходимо поставить коэффициент 2.
$Hg + 2H_2SO_4 \rightarrow HgSO_4 + SO_2 + H_2O$
Далее уравняем атомы водорода. В левой части в $2H_2SO_4$ содержится $2 \times 2 = 4$ атома водорода. Чтобы уравнять их, в правой части перед $H_2O$ нужно поставить коэффициент 2.
$Hg + 2H_2SO_4 \rightarrow HgSO_4 + SO_2 + 2H_2O$
В завершение проведем проверку по атомам кислорода:
- В левой части: $2 \times 4 = 8$ атомов.
- В правой части: $4$ (в $HgSO_4$) $+ 2$ (в $SO_2$) $+ 2 \times 1$ (в $2H_2O$) = $4 + 2 + 2 = 8$ атомов.
Количества всех атомов в левой и правой частях уравнения равны, следовательно, уравнение составлено верно.
Ответ: $Hg + 2H_2SO_4 \text{(конц.)} \rightarrow HgSO_4 + SO_2\uparrow + 2H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 6 расположенного на странице 142 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 142), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















