Номер 9, страница 20 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Тема I. Обобщение знаний по курсу 8 класса. Классификация химических реакций. Вариант 4 - номер 9, страница 20.
№9 (с. 20)
Условие. №9 (с. 20)
скриншот условия

9. Укажите коэффициент перед формулой окислителя в уравнении окислительно-восстановительной реакции, схема которой
$C + HNO_3 \rightarrow NO_2 + CO_2 + H_2O$
1) 1 2) 2 3) 4 4) 6
Решение. №9 (с. 20)
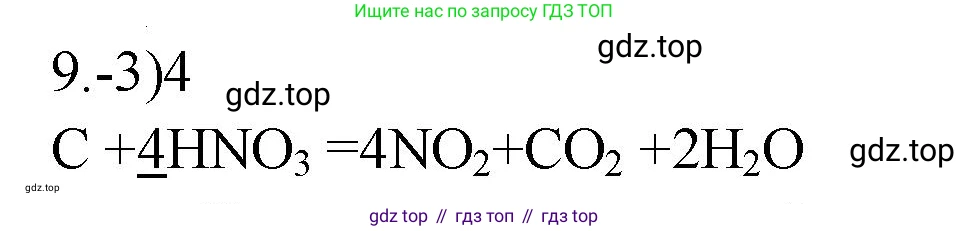
Решение 2. №9 (с. 20)
Дано:
Схема окислительно-восстановительной реакции: $C + HNO_3 \rightarrow NO_2 + CO_2 + H_2O$
Найти:
Коэффициент перед формулой окислителя.
Решение:
Для решения задачи необходимо уравнять данную окислительно-восстановительную реакцию (ОВР) и определить, какое вещество является окислителем.
1. Определим степени окисления элементов в каждом веществе, чтобы найти, какие из них изменяют свою степень окисления.
$ \overset{0}{C} + H\overset{+1}{}\overset{+5}{N}\overset{-2}{O_3} \rightarrow \overset{+4}{N}\overset{-2}{O_2} + \overset{+4}{C}\overset{-2}{O_2} + \overset{+1}{H_2}\overset{-2}{O} $
Из схемы видно, что степени окисления изменяют углерод и азот:
- Углерод (C) повышает степень окисления с 0 до +4.
- Азот (N) понижает степень окисления с +5 до +4.
2. Определим окислитель и восстановитель.
- Элемент, который повышает свою степень окисления, является восстановителем (он отдает электроны). В данном случае это углерод $C^0$.
- Элемент, который понижает свою степень окисления, является окислителем (он принимает электроны). В данном случае это азот $N^{+5}$ в составе азотной кислоты $HNO_3$. Таким образом, окислителем является азотная кислота.
3. Составим электронный баланс, чтобы найти коэффициенты в уравнении.
Процесс окисления (отдача электронов):
$C^0 - 4e^- \rightarrow C^{+4}$
Процесс восстановления (принятие электронов):
$N^{+5} + 1e^- \rightarrow N^{+4}$
Чтобы количество отданных и принятых электронов было равным, найдем наименьшее общее кратное для чисел 4 и 1. Оно равно 4. Тогда коэффициенты для полуреакций будут следующими:
$ \begin{array}{c|c c l} C^{0} - 4e^- \rightarrow C^{+4} & 4 & 1 & \text{восстановитель, окисление} \\ N^{+5} + 1e^- \rightarrow N^{+4} & 1 & 4 & \text{окислитель, восстановление} \end{array} $
4. Расставим полученные коэффициенты в схему реакции. Коэффициент 1 ставится перед $C$ и $CO_2$, а коэффициент 4 — перед $HNO_3$ и $NO_2$.
$1C + 4HNO_3 \rightarrow 4NO_2 + 1CO_2 + H_2O$
5. Уравняем количество атомов водорода и кислорода. В левой части уравнения 4 атома водорода (в $4HNO_3$), в правой — 2 (в $H_2O$). Чтобы уравнять, поставим коэффициент 2 перед $H_2O$.
$C + 4HNO_3 \rightarrow 4NO_2 + CO_2 + 2H_2O$
6. Проверим баланс атомов кислорода:
- Слева: $4 \times 3 = 12$ атомов.
- Справа: $(4 \times 2) + 2 + (2 \times 1) = 8 + 2 + 2 = 12$ атомов.
Баланс достигнут, уравнение реакции составлено верно.
Окислителем в реакции является азотная кислота $HNO_3$. Коэффициент перед ее формулой в уравнении равен 4.
Ответ: 4
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 9 расположенного на странице 20 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №9 (с. 20), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















