Номер 8, страница 20 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Тема I. Обобщение знаний по курсу 8 класса. Классификация химических реакций. Вариант 4 - номер 8, страница 20.
№8 (с. 20)
Условие. №8 (с. 20)
скриншот условия

8. К окислительно-восстановительным относят реакцию, уравнение которой
1) $MgO + H_2SO_4 = MgSO_4 + H_2O$
2) $Cl_2 + 2NaOH = NaCl + NaClO + H_2O$
3) $K_2O + H_2O = 2KOH$
4) $KOH + NH_4Cl = KCl + NH_3 + H_2O$
Решение. №8 (с. 20)
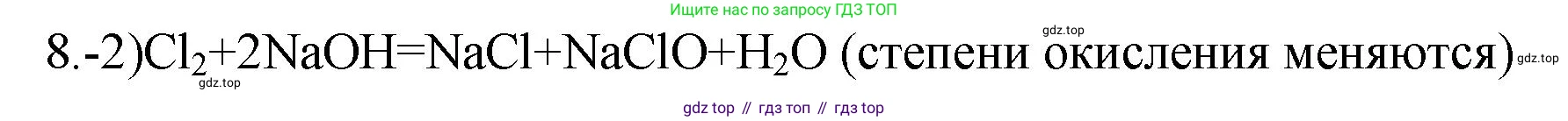
Решение 2. №8 (с. 20)
Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления у атомов одного или нескольких элементов. Чтобы определить, какая из предложенных реакций является ОВР, необходимо проанализировать степени окисления всех элементов в реагентах и продуктах для каждого уравнения.
1) $MgO + H_2SO_4 = MgSO_4 + H_2O$
Проставим степени окисления для каждого элемента в левой и правой частях уравнения: $Mg^{+2}O^{-2} + H_2^{+1}S^{+6}O_4^{-2} = Mg^{+2}S^{+6}O_4^{-2} + H_2^{+1}O^{-2}$. В этой реакции степени окисления всех элементов (магния, кислорода, водорода, серы) остаются неизменными. Следовательно, это не окислительно-восстановительная реакция, а реакция ионного обмена (взаимодействие основного оксида с кислотой).
2) $Cl_2 + 2NaOH = NaCl + NaClO + H_2O$
Проставим степени окисления для каждого элемента: $Cl_2^{0} + 2Na^{+1}O^{-2}H^{+1} = Na^{+1}Cl^{-1} + Na^{+1}Cl^{+1}O^{-2} + H_2^{+1}O^{-2}$. В ходе этой реакции хлор, находясь в простом веществе со степенью окисления 0, одновременно и повышает, и понижает свою степень окисления. Атом хлора переходит из степени окисления $0$ в степень окисления $-1$ ($Cl^0 \rightarrow Cl^{-1}$), принимая электрон (восстанавливается), и в степень окисления $+1$ ($Cl^0 \rightarrow Cl^{+1}$), отдавая электрон (окисляется). Такие реакции, где один и тот же элемент является и окислителем, и восстановителем, называются реакциями диспропорционирования. Поскольку степени окисления изменяются, данная реакция является окислительно-восстановительной.
3) $K_2O + H_2O = 2KOH$
Проставим степени окисления: $K_2^{+1}O^{-2} + H_2^{+1}O^{-2} = 2K^{+1}O^{-2}H^{+1}$. Степени окисления калия, кислорода и водорода не меняются. Это реакция соединения, которая не является ОВР.
4) $KOH + NH_4Cl = KCl + NH_3 + H_2O$
Проставим степени окисления: $K^{+1}O^{-2}H^{+1} + N^{-3}H_4^{+1}Cl^{-1} = K^{+1}Cl^{-1} + N^{-3}H_3^{+1} + H_2^{+1}O^{-2}$. Степени окисления всех элементов (калия, кислорода, водорода, азота, хлора) остаются постоянными. Это реакция ионного обмена, не ОВР.
Таким образом, единственная реакция из предложенных, в которой изменяются степени окисления элементов, — это реакция под номером 2.
Ответ: 2
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 8 расположенного на странице 20 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 20), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















