Номер 13, страница 39 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Тема I. Химические реакции в водных растворах. Химические свойства кислот как электролитов. Вариант 1 - номер 13, страница 39.
№13 (с. 39)
Условие. №13 (с. 39)
скриншот условия

13. Напишите молекулярные и ионные уравнения, с помощью которых можно осуществить следующие превращения:
$MnO \rightarrow MnCl_2 \rightarrow Mn(OH)_2$
Решение. №13 (с. 39)
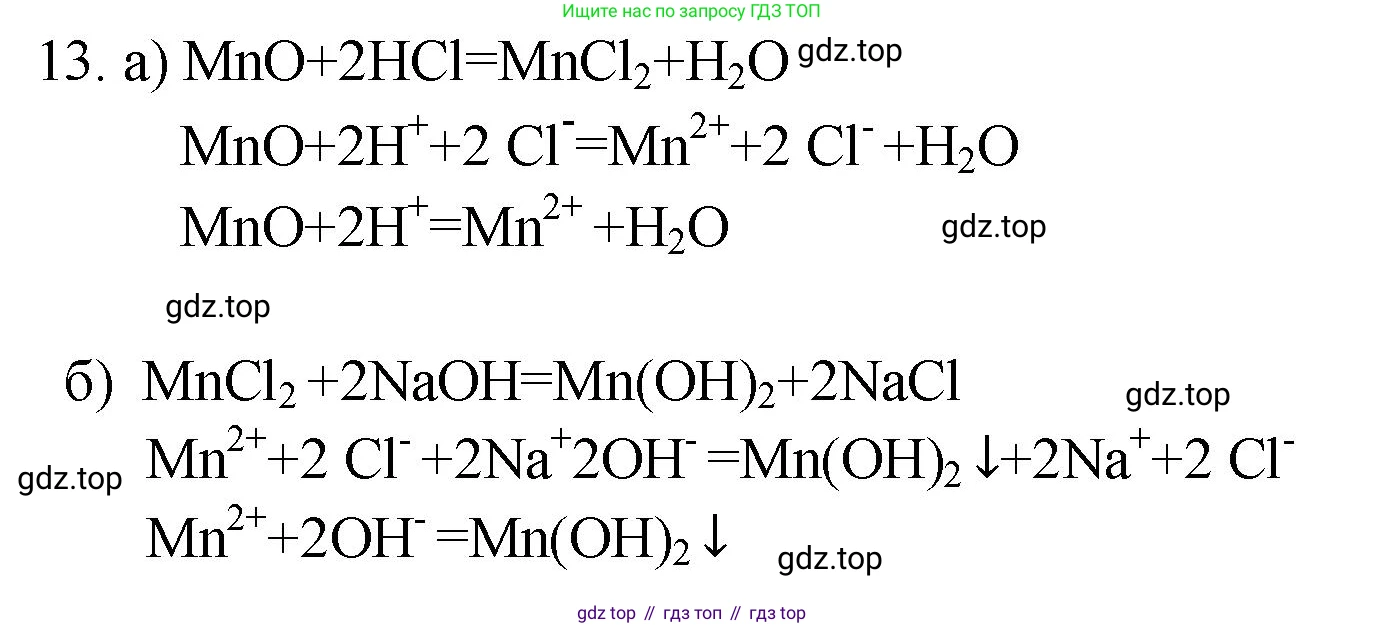
Решение 2. №13 (с. 39)
MnO → MnCl2
Решение:
Для осуществления данного превращения необходимо провести реакцию между оксидом марганца(II) и кислотой. Оксид марганца(II) (MnO) является основным оксидом, который реагирует с кислотами с образованием соли и воды. Чтобы получить хлорид марганца(II) (MnCl2), в качестве реагента следует использовать соляную кислоту (HCl).
Молекулярное уравнение реакции выглядит следующим образом:
MnO + 2HCl → MnCl2 + H2O
Теперь запишем ионные уравнения. MnO - нерастворимый в воде оксид, записывается в молекулярном виде. HCl - сильная кислота, диссоциирует на ионы. MnCl2 - растворимая соль, также диссоциирует. H2O - слабый электролит, записывается в молекулярном виде.
Полное ионное уравнение:
MnO + 2H+ + 2Cl− → Mn2+ + 2Cl− + H2O
Для получения сокращенного ионного уравнения необходимо исключить из обеих частей полного ионного уравнения одинаковые ионы (в данном случае это хлорид-ионы Cl−).
Сокращенное ионное уравнение:
MnO + 2H+ → Mn2+ + H2O
Ответ:
Молекулярное уравнение: MnO + 2HCl → MnCl2 + H2O
Полное ионное уравнение: MnO + 2H+ + 2Cl− → Mn2+ + 2Cl− + H2O
Сокращенное ионное уравнение: MnO + 2H+ → Mn2+ + H2O
MnCl2 → Mn(OH)2
Решение:
Для получения гидроксида марганца(II) (Mn(OH)2) из его растворимой соли хлорида марганца(II) (MnCl2) необходимо провести реакцию обмена с растворимым основанием (щелочью). В результате реакции образуется нерастворимый гидроксид Mn(OH)2, который выпадает в осадок. В качестве щелочи можно использовать, например, гидроксид натрия (NaOH) или гидроксид калия (KOH). Возьмем для примера NaOH.
Молекулярное уравнение реакции:
MnCl2 + 2NaOH → Mn(OH)2↓ + 2NaCl
Запишем ионные уравнения. MnCl2, NaOH и NaCl - растворимые сильные электролиты, они диссоциируют на ионы. Mn(OH)2 - нерастворимое основание (осадок), записывается в молекулярном виде.
Полное ионное уравнение:
Mn2+ + 2Cl− + 2Na+ + 2OH− → Mn(OH)2↓ + 2Na+ + 2Cl−
Исключив одинаковые ионы (Na+ и Cl−) из обеих частей уравнения, получим сокращенное ионное уравнение.
Сокращенное ионное уравнение:
Mn2+ + 2OH− → Mn(OH)2↓
Ответ:
Молекулярное уравнение: MnCl2 + 2NaOH → Mn(OH)2↓ + 2NaCl
Полное ионное уравнение: Mn2+ + 2Cl− + 2Na+ + 2OH− → Mn(OH)2↓ + 2Na+ + 2Cl−
Сокращенное ионное уравнение: Mn2+ + 2OH− → Mn(OH)2↓
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 13 расположенного на странице 39 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №13 (с. 39), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















