Номер 13, страница 160 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Контрольные работы. Электролитическая диссоциация. Вариант 3 - номер 13, страница 160.
№13 (с. 160)
Условие. №13 (с. 160)
скриншот условия
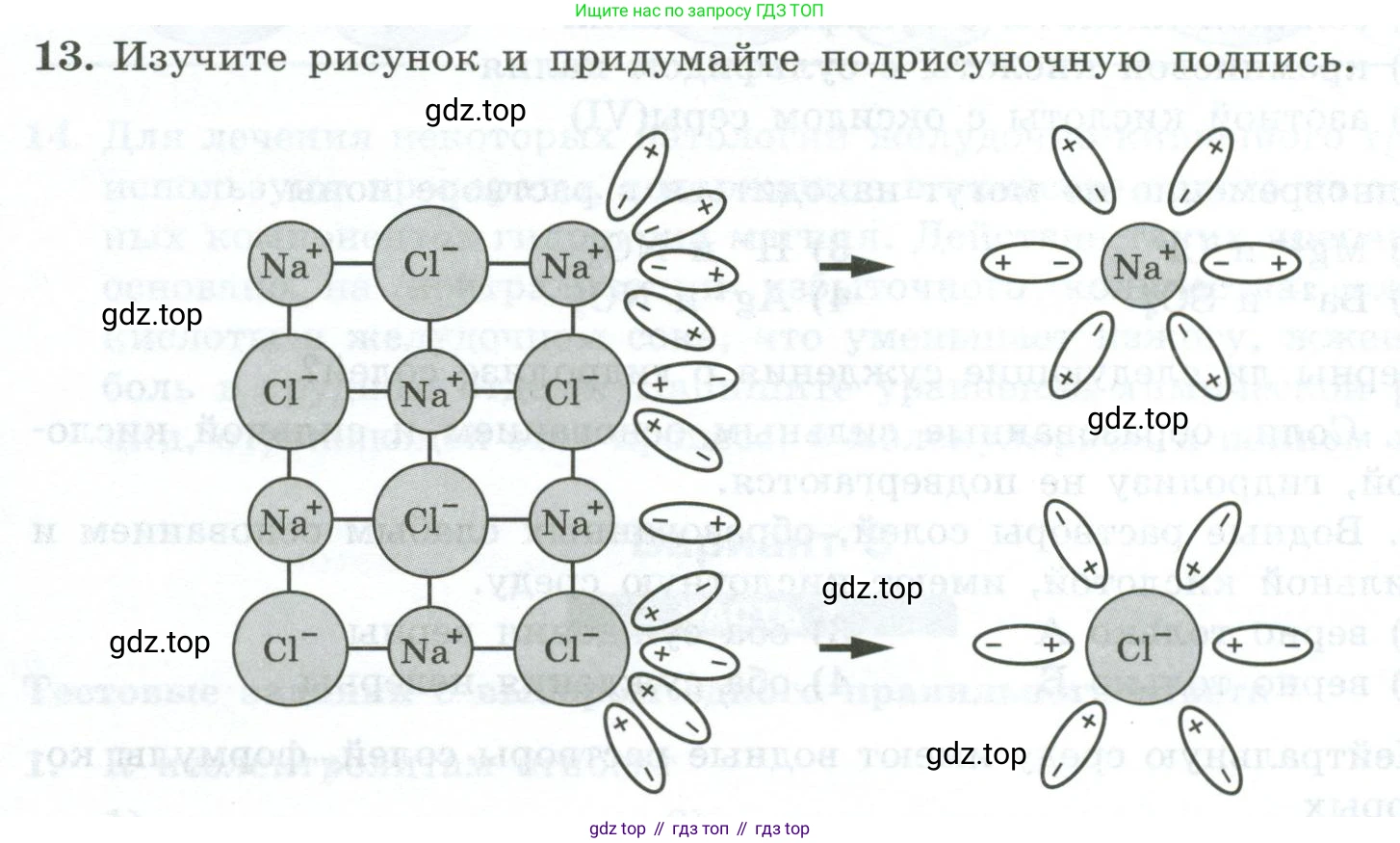
13. Изучите рисунок и придумайте подрисуночную подпись.
Растворение $NaCl$ в воде. Показаны ионы $Na^+$ и $Cl^-$ в кристаллической решетке и их гидратация полярными молекулами воды при переходе в раствор.
Решение. №13 (с. 160)

Решение 2. №13 (с. 160)
На рисунке схематически изображен процесс растворения ионного кристалла (на примере хлорида натрия, $NaCl$) в полярном растворителе (например, в воде).
Слева показана часть кристаллической решетки хлорида натрия. Она состоит из чередующихся положительно заряженных ионов натрия ($Na^+$) и отрицательно заряженных хлорид-ионов ($Cl^−$). Эти ионы прочно связаны друг с другом силами электростатического притяжения, образуя ионную связь.
Овальные частицы с полюсами «+» и «−» представляют собой дипольные молекулы полярного растворителя (например, молекулы воды $H_2O$). В таких молекулах электрический заряд распределен неравномерно, образуя два полюса: положительный и отрицательный.
Процесс, показанный стрелкой, иллюстрирует взаимодействие молекул растворителя с ионами на поверхности кристалла. Молекулы-диполи ориентируются вокруг ионов кристалла в соответствии с их зарядом:
- Отрицательные полюса молекул растворителя притягиваются к положительным ионам натрия ($Na^+$).
- Положительные полюса молекул растворителя притягиваются к отрицательным хлорид-ионам ($Cl^−$).
Справа показан конечный результат этого взаимодействия. Совместное действие нескольких молекул растворителя создает силу притяжения, достаточную для того, чтобы преодолеть ионные связи в кристалле и "вырвать" ион из решетки. После перехода в раствор каждый ион окружается упорядоченным слоем молекул растворителя, образуя так называемую гидратную (или сольватную) оболочку. Ионы в такой оболочке называются гидратированными (сольватированными). Этот процесс, называемый электролитической диссоциацией, приводит к разрушению кристаллической решетки и растворению вещества.
Ответ:
Подрисуночная подпись: Схематическое изображение процесса растворения ионного кристалла хлорида натрия ($NaCl$) в полярном растворителе. Дипольные молекулы растворителя (например, воды) взаимодействуют с ионами на поверхности кристалла, что приводит к разрушению кристаллической решетки и переходу гидратированных ионов ($Na^+$ и $Cl^−$) в раствор.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 13 расположенного на странице 160 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №13 (с. 160), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















