Номер 13, страница 182 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Контрольные работы. Итоговая контрольная работа. Вариант 1 - номер 13, страница 182.
№13 (с. 182)
Условие. №13 (с. 182)
скриншот условия

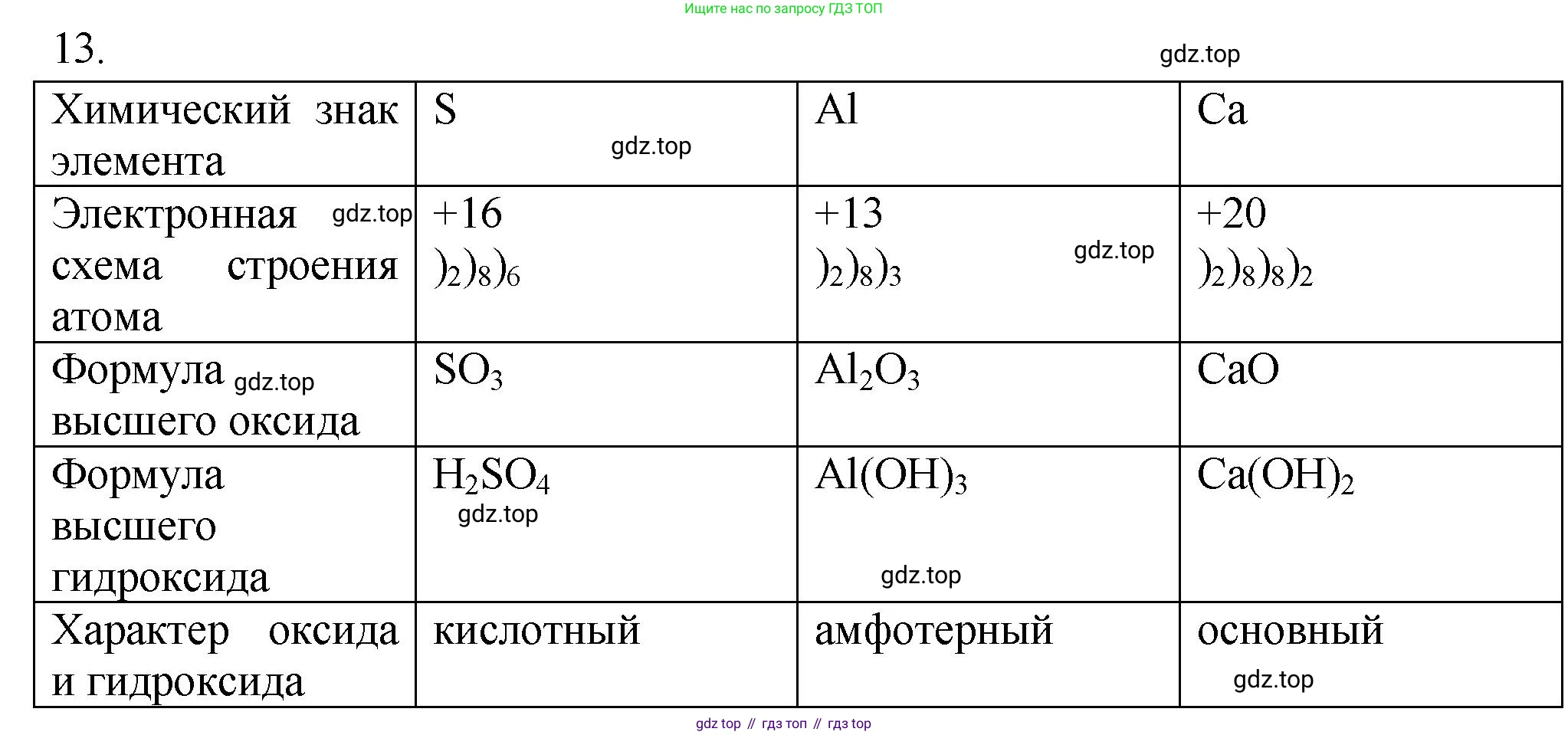
13. Заполните в тетради таблицу.
Химический знак элемента S
Электронная схема строения атома $ (+20) $ ))) $ 2 \ 8 \ 8 \ 2 $
Формула высшего оксида $ Al_2O_3 $
Формула высшего гидроксида
Характер оксида и гидроксида
Решение. №13 (с. 182)
Решение 2. №13 (с. 182)
Для заполнения таблицы необходимо проанализировать данные для каждого элемента.
Анализ столбца 1 (Элемент по химическому знаку)
Дано:
Химический знак элемента: S (сера).
Найти:
- Электронная схема строения атома
- Формула высшего оксида
- Формула высшего гидроксида
- Характер оксида и гидроксида
Решение:
Электронная схема строения атома: Сера (S) — элемент с порядковым номером 16 в Периодической системе. Это означает, что заряд ядра атома серы равен +16, и в его электронной оболочке находится 16 электронов. Сера расположена в 3-м периоде, следовательно, электроны распределены по трем энергетическим уровням. Так как сера находится в VIA (16-й) группе, на внешнем уровне у неё 6 электронов. Таким образом, распределение электронов по уровням: 2 электрона на первом, 8 на втором и 6 на третьем. Схема строения атома: +16 ) ) ) 2 8 6.
Формула высшего оксида: Высшая степень окисления элемента главной подгруппы, как правило, равна номеру группы. Для серы это +6. Формула оксида, в котором элемент проявляет высшую степень окисления, составляется с учётом степени окисления кислорода (-2). Для электронейтральности молекулы на один атом серы $S^{+6}$ требуется три атома кислорода $O^{-2}$. Формула высшего оксида: $SO_3$.
Формула высшего гидроксида: Высшему оксиду неметалла соответствует кислота. Оксиду серы(VI) $SO_3$ соответствует серная кислота, формула которой $H_2SO_4$.
Характер оксида и гидроксида: Оксид $SO_3$ является типичным кислотным оксидом, так как ему соответствует сильная серная кислота ($H_2SO_4$). Следовательно, характер оксида и гидроксида — кислотный.
Ответ: Электронная схема строения атома: +16 ) ) ) 2 8 6; формула высшего оксида: $SO_3$; формула высшего гидроксида: $H_2SO_4$; характер оксида и гидроксида: кислотный.
Анализ столбца 2 (Элемент по формуле высшего оксида)
Дано:
Формула высшего оксида: $Al_2O_3$.
Найти:
- Химический знак элемента
- Электронная схема строения атома
- Формула высшего гидроксида
- Характер оксида и гидроксида
Решение:
Химический знак элемента: В формуле $Al_2O_3$ указан химический знак элемента — Al. Это алюминий.
Электронная схема строения атома: Алюминий (Al) имеет порядковый номер 13. Заряд ядра его атома +13, общее число электронов — 13. Элемент находится в 3-м периоде, значит, у него 3 электронных слоя. Алюминий — элемент IIIA (13-й) группы, поэтому на внешнем слое у него 3 электрона. Распределение электронов по слоям: 2, 8, 3. Схема строения атома: +13 ) ) ) 2 8 3.
Формула высшего гидроксида: В оксиде $Al_2O_3$ алюминий проявляет степень окисления +3. Гидроксид, соответствующий этому оксиду, — гидроксид алюминия. Его формула составляется из иона $Al^{3+}$ и гидроксогрупп $OH^{-}$. Формула высшего гидроксида: $Al(OH)_3$.
Характер оксида и гидроксида: Оксид алюминия $Al_2O_3$ и гидроксид алюминия $Al(OH)_3$ проявляют двойственные свойства: они реагируют и с кислотами, и с щелочами. Такие соединения называют амфотерными. Следовательно, характер оксида и гидроксида — амфотерный.
Ответ: Химический знак элемента: Al; электронная схема строения атома: +13 ) ) ) 2 8 3; формула высшего гидроксида: $Al(OH)_3$; характер оксида и гидроксида: амфотерный.
Анализ столбца 3 (Элемент по электронной схеме)
Дано:
Электронная схема строения атома: +20 ) ) ) ) 2 8 8 2.
Найти:
- Химический знак элемента
- Формула высшего оксида
- Формула высшего гидроксида
- Характер оксида и гидроксида
Решение:
Химический знак элемента: Заряд ядра атома, указанный в схеме, равен +20. Элемент с таким зарядом ядра имеет порядковый номер 20. В Периодической системе это кальций (Ca).
Формула высшего оксида: Кальций — элемент IIA (2-й) группы, 4-го периода. Как металл второй группы, он проявляет постоянную степень окисления +2. Эта степень окисления является для него высшей. Формула оксида с кислородом (степень окисления -2): $Ca^{+2}O^{-2}$, то есть $CaO$.
Формула высшего гидроксида: Оксиду кальция $CaO$ (основный оксид) соответствует основание — гидроксид кальция. Формула составляется из иона $Ca^{2+}$ и гидроксогрупп $OH^{-}$. Формула высшего гидроксида: $Ca(OH)_2$.
Характер оксида и гидроксида: Кальций — щелочноземельный металл. Его оксид $CaO$ является основным оксидом, а гидроксид $Ca(OH)_2$ — сильным основанием (щелочью). Следовательно, характер оксида и гидроксида — основный.
Ответ: Химический знак элемента: Ca; формула высшего оксида: $CaO$; формула высшего гидроксида: $Ca(OH)_2$; характер оксида и гидроксида: основный.
Итоговая заполненная таблица:
| Элемент 1 | Элемент 2 | Элемент 3 | |
|---|---|---|---|
| Химический знак элемента | S | Al | Ca |
| Электронная схема строения атома | +16 ) ) ) 2 8 6 | +13 ) ) ) 2 8 3 | +20 ) ) ) ) 2 8 8 2 |
| Формула высшего оксида | $SO_3$ | $Al_2O_3$ | $CaO$ |
| Формула высшего гидроксида | $H_2SO_4$ | $Al(OH)_3$ | $Ca(OH)_2$ |
| Характер оксида и гидроксида | Кислотный | Амфотерный | Основный |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 13 расположенного на странице 182 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №13 (с. 182), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















