Номер 2, страница 45 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §10. Общая характеристика неметаллов. Часть 2 - номер 2, страница 45.
№2 (с. 45)
Условие. №2 (с. 45)
скриншот условия

2. Составьте уравнения реакций, соответствующих следующей схеме:
$Cl_2 \to HCl \xrightarrow{MnO_2} Cl_2 \to KClO_3 \to KCl$
Рассмотрите окислительно-восстановительные реакции с позиций окисления—восстановления.
Решение. №2 (с. 45)
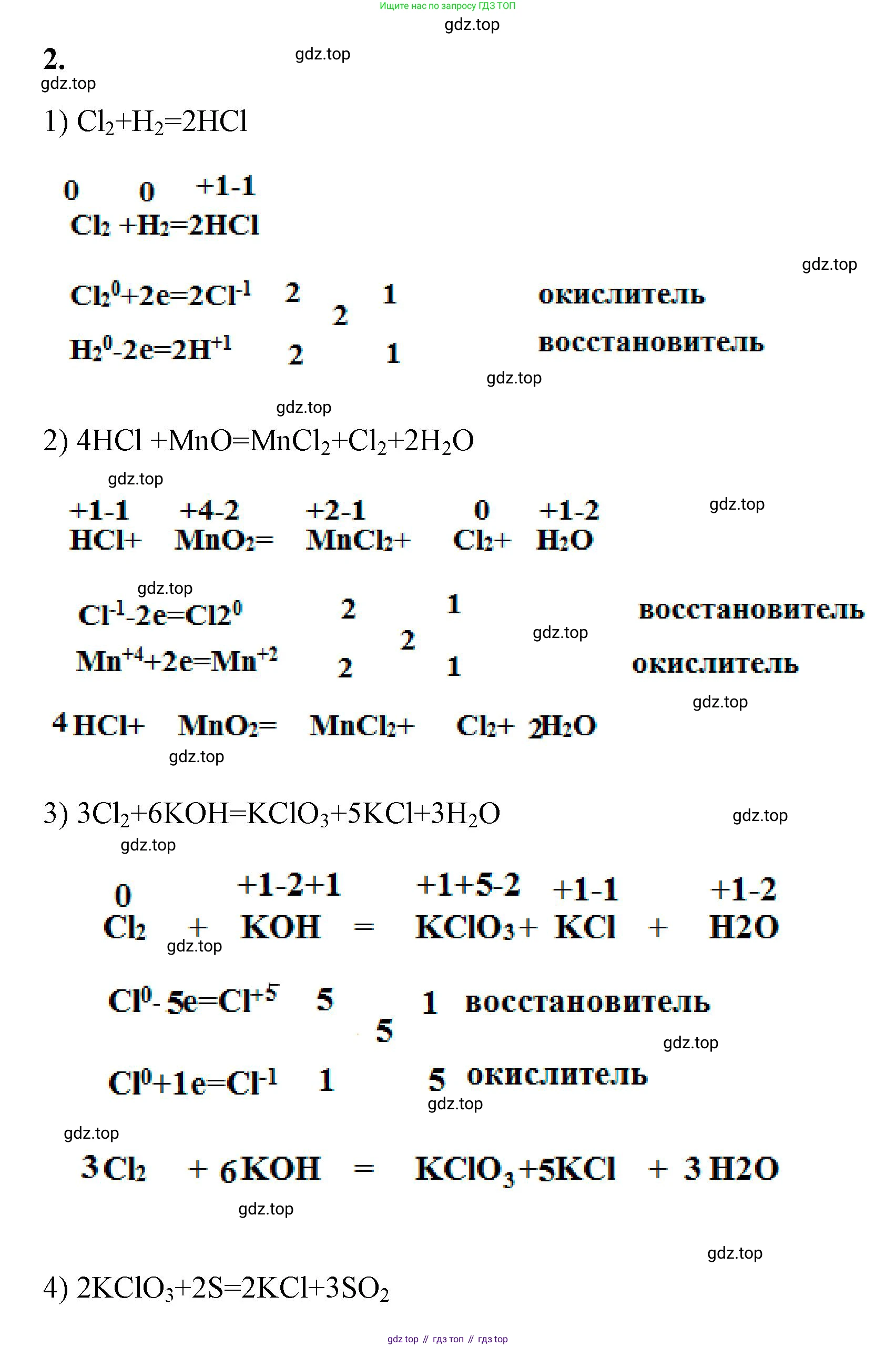

Решение 2. №2 (с. 45)
Решение
1. $Cl_2 \rightarrow HCl$
Для получения хлороводорода из хлора необходимо провести реакцию хлора с водородом. Реакция протекает при освещении (квант света $h\nu$) или нагревании.
Уравнение реакции: $H_2 + Cl_2 \xrightarrow{h\nu} 2HCl$
Это окислительно-восстановительная реакция. Рассмотрим степени окисления элементов:
$H_2^0 + Cl_2^0 \rightarrow 2H^{+1}Cl^{-1}$
Водород ($H_2$) повышает свою степень окисления с 0 до +1, он является восстановителем (подвергается окислению).
Хлор ($Cl_2$) понижает свою степень окисления с 0 до -1, он является окислителем (подвергается восстановлению).
Процессы окисления и восстановления:
$H_2^0 - 2e^- \rightarrow 2H^{+1}$ (процесс окисления)
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ (процесс восстановления)
Ответ: $H_2 + Cl_2 \rightarrow 2HCl$
2. $HCl \xrightarrow{MnO_2} Cl_2$
Получение хлора из соляной кислоты в лабораторных условиях проводят реакцией концентрированной соляной кислоты с оксидом марганца(IV) при нагревании.
Уравнение реакции: $4HCl_{(конц.)} + MnO_2 \xrightarrow{t} MnCl_2 + Cl_2 \uparrow + 2H_2O$
Это окислительно-восстановительная реакция. Рассмотрим изменение степеней окисления:
$4H^{+1}Cl^{-1} + Mn^{+4}O_2^{-2} \rightarrow Mn^{+2}Cl_2^{-1} + Cl_2^0 + 2H_2^{+1}O^{-2}$
Марганец в $MnO_2$ ($Mn^{+4}$) понижает свою степень окисления до +2, следовательно, $MnO_2$ является окислителем.
Хлор в $HCl$ ($Cl^{-1}$) повышает свою степень окисления до 0, следовательно, $HCl$ является восстановителем. Стоит отметить, что часть ионов хлора не меняет степень окисления, переходя в состав соли $MnCl_2$.
Процессы окисления и восстановления:
$Mn^{+4} + 2e^- \rightarrow Mn^{+2}$ (процесс восстановления)
$2Cl^{-1} - 2e^- \rightarrow Cl_2^0$ (процесс окисления)
Ответ: $4HCl + MnO_2 \rightarrow MnCl_2 + Cl_2 + 2H_2O$
3. $Cl_2 \rightarrow KClO_3$
Для получения хлората калия ($KClO_3$) необходимо пропустить хлор через горячий концентрированный раствор гидроксида калия ($KOH$).
Уравнение реакции: $3Cl_2 + 6KOH_{(конц.)} \xrightarrow{t} KClO_3 + 5KCl + 3H_2O$
Это реакция диспропорционирования, в которой один и тот же элемент (хлор) является одновременно и окислителем, и восстановителем.
Рассмотрим изменение степеней окисления: $3Cl_2^0 + 6K^{+1}O^{-2}H^{+1} \rightarrow K^{+1}Cl^{+5}O_3^{-2} + 5K^{+1}Cl^{-1} + 3H_2^{+1}O^{-2}$
Атомы хлора из $Cl_2^0$ одновременно повышают степень окисления до +5 (в $KClO_3$), выступая как восстановитель, и понижают до -1 (в $KCl$), выступая как окислитель.
Процессы окисления и восстановления:
$Cl_2^0 - 10e^- \rightarrow 2Cl^{+5}$ (процесс окисления)
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ (процесс восстановления)
Для уравнивания числа отданных и принятых электронов, перед процессом восстановления ставим коэффициент 5. Таким образом, в реакции участвует $1+5=6$ атомов хлора (или 3 молекулы $Cl_2$).
Ответ: $3Cl_2 + 6KOH \rightarrow KClO_3 + 5KCl + 3H_2O$
4. $KClO_3 \rightarrow KCl$
Хлорид калия ($KCl$) можно получить из хлората калия ($KClO_3$) путем его каталитического термического разложения. В качестве катализатора часто используют оксид марганца(IV) $MnO_2$.
Уравнение реакции: $2KClO_3 \xrightarrow{t, MnO_2} 2KCl + 3O_2 \uparrow$
Это внутримолекулярная окислительно-восстановительная реакция.
Рассмотрим изменение степеней окисления: $2K^{+1}Cl^{+5}O_3^{-2} \rightarrow 2K^{+1}Cl^{-1} + 3O_2^0$
Хлор ($Cl^{+5}$) понижает свою степень окисления до -1, являясь окислителем.
Кислород ($O^{-2}$) повышает свою степень окисления до 0, являясь восстановителем.
Процессы окисления и восстановления:
$Cl^{+5} + 6e^- \rightarrow Cl^{-1}$ (процесс восстановления)
$2O^{-2} - 4e^- \rightarrow O_2^0$ (процесс окисления)
Наименьшее общее кратное для электронов (6 и 4) равно 12. Поэтому первый процесс умножаем на 2, а второй на 3. Это дает нам коэффициенты: 2 для $KClO_3$ и $KCl$, и 3 для $O_2$.
Ответ: $2KClO_3 \rightarrow 2KCl + 3O_2$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 45 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 45), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















