Номер 5, страница 42 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава II. Химические реакции в водных растворах. §9. Гидролиз солей. Часть 2 - номер 5, страница 42.
№5 (с. 42)
Условие. №5 (с. 42)
скриншот условия

5. Одна из наиболее сильных кислот — хлорная кислота $HClO_4$. Предложите два примера гидролиза по катиону её солей — хлоратов.
1)
Решение. №5 (с. 42)
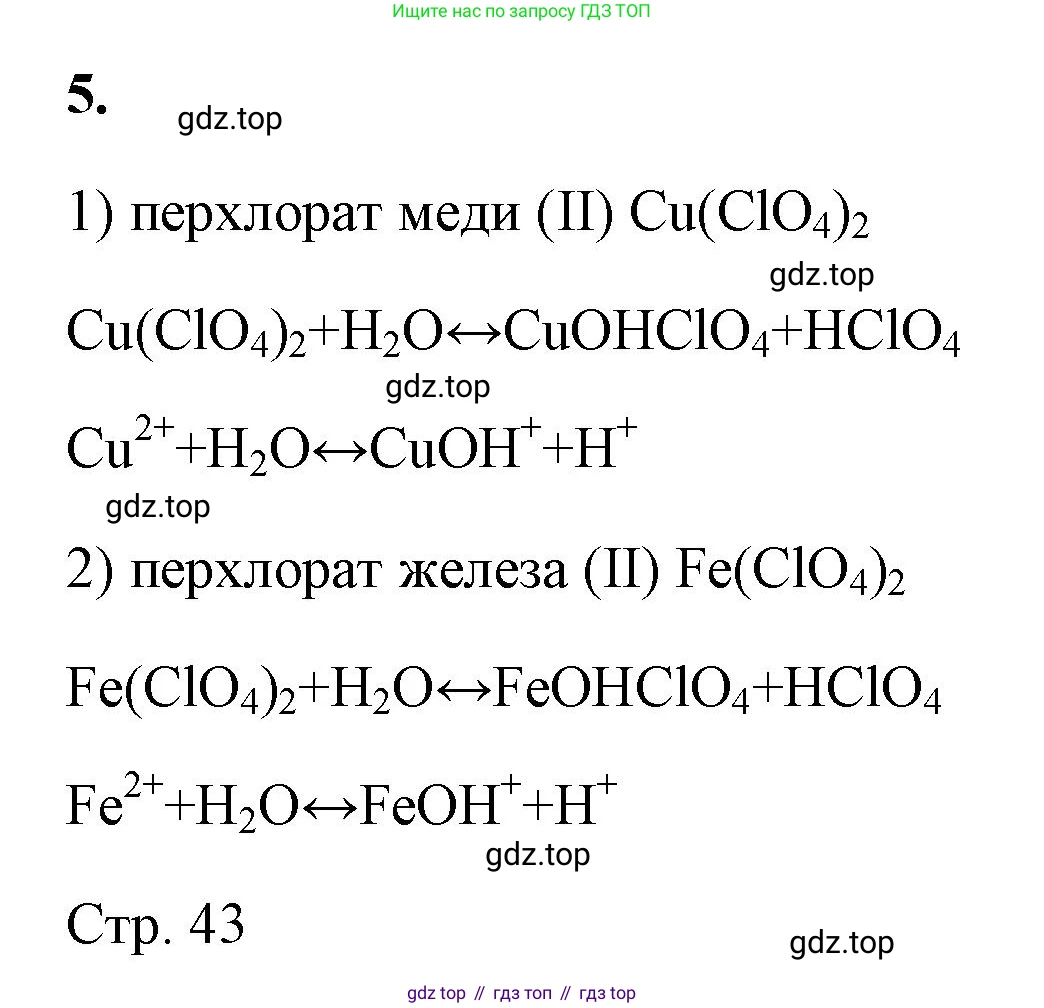
Решение 2. №5 (с. 42)
Хлорная кислота $HClO_4$ — это одна из сильнейших неорганических кислот. Её соли называются перхлоратами. Гидролиз солей по катиону происходит в том случае, если соль образована катионом слабого основания и анионом сильной кислоты. Поскольку перхлорат-ион $ClO_4^-$ является анионом сильной кислоты, он не подвергается гидролизу. Следовательно, гидролиз перхлоратов будет протекать по катиону, если соль образована слабым основанием. В результате реакции катиона с водой в растворе будут накапливаться ионы водорода $H^+$, и среда станет кислой ($pH < 7$).
Ниже приведены два примера такого гидролиза.
1) Гидролиз перхлората аммония ($NH_4ClO_4$)
Эта соль образована катионом аммония $NH_4^+$, который соответствует слабому основанию — гидрату аммиака $NH_3 \cdot H_2O$, и перхлорат-анионом $ClO_4^-$. При растворении в воде соль диссоциирует на ионы:
$NH_4ClO_4 \rightarrow NH_4^+ + ClO_4^-$
Катион аммония взаимодействует с водой (гидролизуется), что приводит к образованию ионов водорода и созданию кислой среды. Уравнение гидролиза в сокращенной ионной форме выглядит следующим образом:
$NH_4^+ + H_2O \rightleftharpoons NH_3 \cdot H_2O + H^+$
Ответ: Первым примером является гидролиз перхлората аммония. Сокращенное ионное уравнение гидролиза: $NH_4^+ + H_2O \rightleftharpoons NH_3 \cdot H_2O + H^+$.
2) Гидролиз перхлората алюминия ($Al(ClO_4)_3$)
Эта соль образована катионом алюминия $Al^{3+}$, который соответствует слабому нерастворимому основанию — гидроксиду алюминия $Al(OH)_3$, и перхлорат-анионом $ClO_4^-$. Диссоциация соли в воде:
$Al(ClO_4)_3 \rightarrow Al^{3+} + 3ClO_4^-$
Гидролиз многозарядного катиона $Al^{3+}$ протекает ступенчато. Наибольший вклад в изменение кислотности среды вносит первая ступень гидролиза:
$Al^{3+} + H_2O \rightleftharpoons Al(OH)^{2+} + H^+$
Как и в первом примере, в результате реакции образуются ионы водорода, и раствор приобретает выраженную кислую реакцию среды.
Ответ: Вторым примером является гидролиз перхлората алюминия. Сокращенное ионное уравнение первой ступени гидролиза: $Al^{3+} + H_2O \rightleftharpoons Al(OH)^{2+} + H^+$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 42 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 42), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















