Номер 3, страница 41 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава II. Химические реакции в водных растворах. §9. Гидролиз солей. Часть 2 - номер 3, страница 41.
№3 (с. 41)
Условие. №3 (с. 41)
скриншот условия

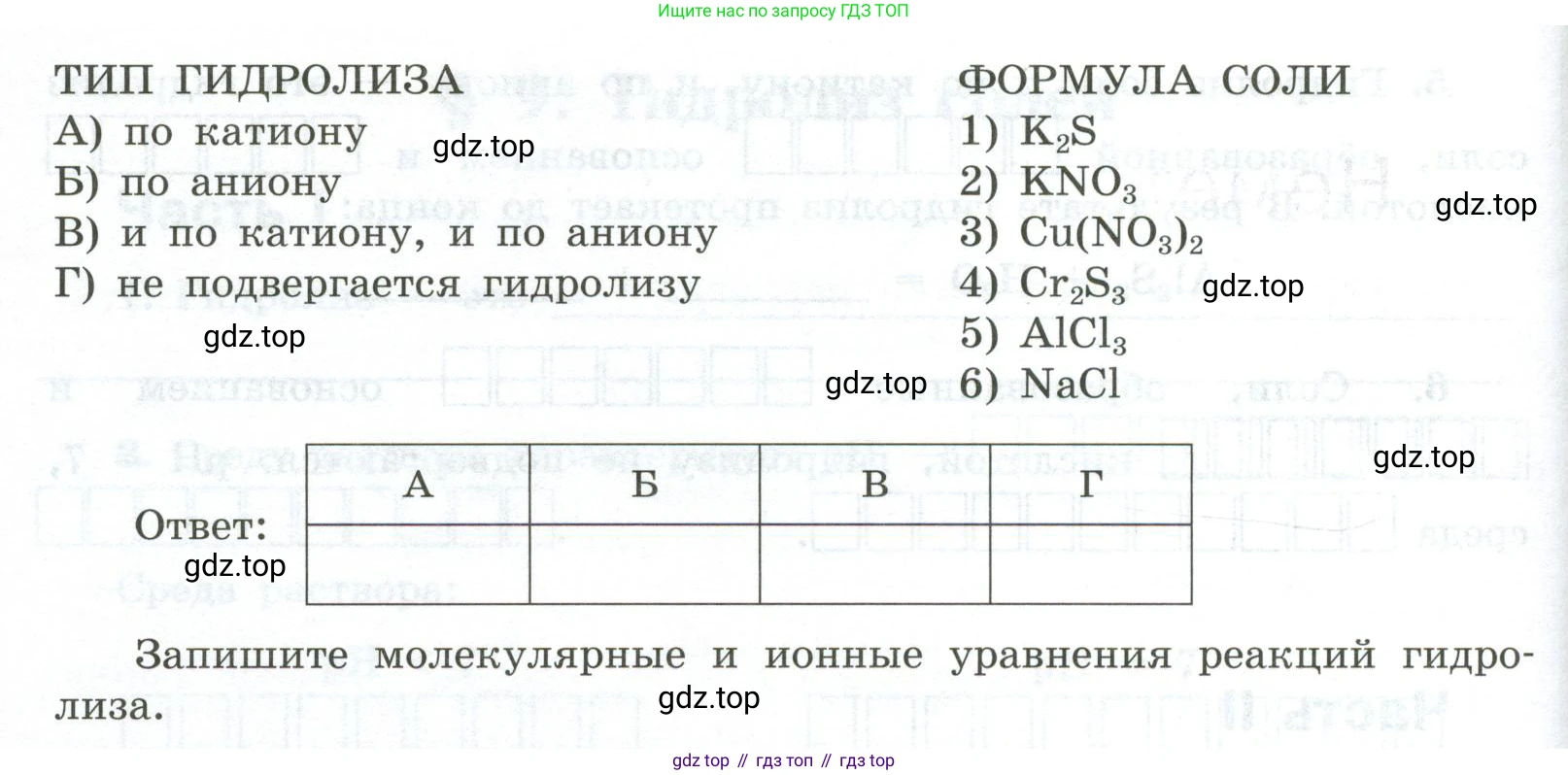
3. Установите соответствие между типом гидролиза и формулой соли.
ТИП ГИДРОЛИЗА
А) по катиону
Б) по аниону
В) и по катиону, и по аниону
Г) не подвергается гидролизу
ФОРМУЛА СОЛИ
1) $K_2S$
2) $KNO_3$
3) $Cu(NO_3)_2$
4) $Cr_2S_3$
5) $AlCl_3$
6) $NaCl$
Ответ:
| А | Б | В | Г |
|---|---|---|---|
Запишите молекулярные и ионные уравнения реакций гидролиза.
Решение. №3 (с. 41)


Решение 2. №3 (с. 41)
Решение
Гидролиз соли — это реакция обменного взаимодействия ионов соли с молекулами воды, приводящая к образованию слабого электролита (слабой кислоты или слабого основания). Тип гидролиза зависит от силы кислоты и основания, образующих соль.
- Гидролиз по катиону происходит, если соль образована слабым основанием и сильной кислотой. Среда раствора кислая ($pH < 7$).
- Гидролиз по аниону происходит, если соль образована сильным основанием и слабой кислотой. Среда раствора щелочная ($pH > 7$).
- Гидролиз и по катиону, и по аниону происходит, если соль образована слабым основанием и слабой кислотой. Среда раствора может быть нейтральной, кислой или щелочной в зависимости от относительной силы кислоты и основания.
- Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой. Среда раствора нейтральная ($pH \approx 7$).
Проанализируем соли из списка:
1) $K_2S$ (сульфид калия) – соль сильного основания ($KOH$) и слабой кислоты ($H_2S$).
2) $KNO_3$ (нитрат калия) – соль сильного основания ($KOH$) и сильной кислоты ($HNO_3$).
3) $Cu(NO_3)_2$ (нитрат меди(II)) – соль слабого основания ($Cu(OH)_2$) и сильной кислоты ($HNO_3$).
4) $Cr_2S_3$ (сульфид хрома(III)) – соль слабого основания ($Cr(OH)_3$) и слабой кислоты ($H_2S$).
5) $AlCl_3$ (хлорид алюминия) – соль слабого основания ($Al(OH)_3$) и сильной кислоты ($HCl$).
6) $NaCl$ (хлорид натрия) – соль сильного основания ($NaOH$) и сильной кислоты ($HCl$).
А) по катиону
Гидролизу по катиону подвергаются соли слабого основания и сильной кислоты. Этому условию соответствуют $Cu(NO_3)_2$ (3) и $AlCl_3$ (5). Выберем $Cu(NO_3)_2$. Гидролиз идет по катиону меди $Cu^{2+}$, что приводит к подкислению раствора.
Молекулярное уравнение (I ступень):
$Cu(NO_3)_2 + H_2O \leftrightarrow CuOHNO_3 + HNO_3$
Полное ионное уравнение:
$Cu^{2+} + 2NO_3^- + H_2O \leftrightarrow CuOH^+ + NO_3^- + H^+ + NO_3^-$
Сокращенное ионное уравнение:
$Cu^{2+} + H_2O \leftrightarrow CuOH^+ + H^+$
Ответ: 3
Б) по аниону
Гидролизу по аниону подвергаются соли сильного основания и слабой кислоты. Этому условию соответствует $K_2S$ (1). Гидролиз идет по сульфид-аниону $S^{2-}$, что приводит к подщелачиванию раствора.
Молекулярное уравнение (I ступень):
$K_2S + H_2O \leftrightarrow KHS + KOH$
Полное ионное уравнение:
$2K^+ + S^{2-} + H_2O \leftrightarrow K^+ + HS^- + K^+ + OH^-$
Сокращенное ионное уравнение:
$S^{2-} + H_2O \leftrightarrow HS^- + OH^-$
Ответ: 1
В) и по катиону, и по аниону
Совместному гидролизу подвергаются соли слабого основания и слабой кислоты. Этому условию соответствует $Cr_2S_3$ (4). В данном случае гидролиз является полным и необратимым, так как оба продукта реакции — осадок $Cr(OH)_3$ и газ $H_2S$ — уходят из сферы реакции.
Молекулярное уравнение:
$Cr_2S_3 + 6H_2O \rightarrow 2Cr(OH)_3\downarrow + 3H_2S\uparrow$
Ионное уравнение:
$2Cr^{3+} + 3S^{2-} + 6H_2O \rightarrow 2Cr(OH)_3\downarrow + 3H_2S\uparrow$
Ответ: 4
Г) не подвергается гидролизу
Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой. Этому условию соответствуют $KNO_3$ (2) и $NaCl$ (6). Выберем $KNO_3$. Ни катион $K^+$, ни анион $NO_3^-$ с водой не реагируют, среда раствора остается нейтральной.
В водном растворе происходит только диссоциация на ионы:
$KNO_3 \xrightarrow{H_2O} K^+ + NO_3^-$
Ответ: 2
Заполненная таблица:
| А | Б | В | Г |
| 3 | 1 | 4 | 2 |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 41 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 41), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















