Номер 3, страница 58 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §14. Сероводород и сульфиды. Часть 1 - номер 3, страница 58.
№3 (с. 58)
Условие. №3 (с. 58)
скриншот условия

3. За счёт атома серы $H_2S$ проявляет только ____ свойства.
Рассмотрите следующие окислительно-восстановительные реакции с позиции окисления—восстановления:
1) H₂S + SO₂
$H_2S + SO_2 = \rule{5em}{0.4pt} + \rule{5em}{0.4pt}$
2) H₂S + O₂ (избыток)
$H_2S + O_2$ (избыток) $= \rule{5em}{0.4pt} + \rule{5em}{0.4pt}$
3) H₂S + O₂ (недостаток)
$H_2S + O_2$ (недостаток) $= \rule{5em}{0.4pt} + \rule{5em}{0.4pt}$
Раствор сероводорода в воде проявляет свойства слабой кислоты. Запишите молекулярные и ионные уравнения следующих реакций:
1) H₂S + NaOH
$H_2S + NaOH = \rule{5em}{0.4pt} + \rule{5em}{0.4pt}$
2) H₂S + Pb(NO₃)₂
$H_2S + Pb(NO_3)_2 = \rule{5em}{0.4pt} + \rule{5em}{0.4pt}$
Решение. №3 (с. 58)

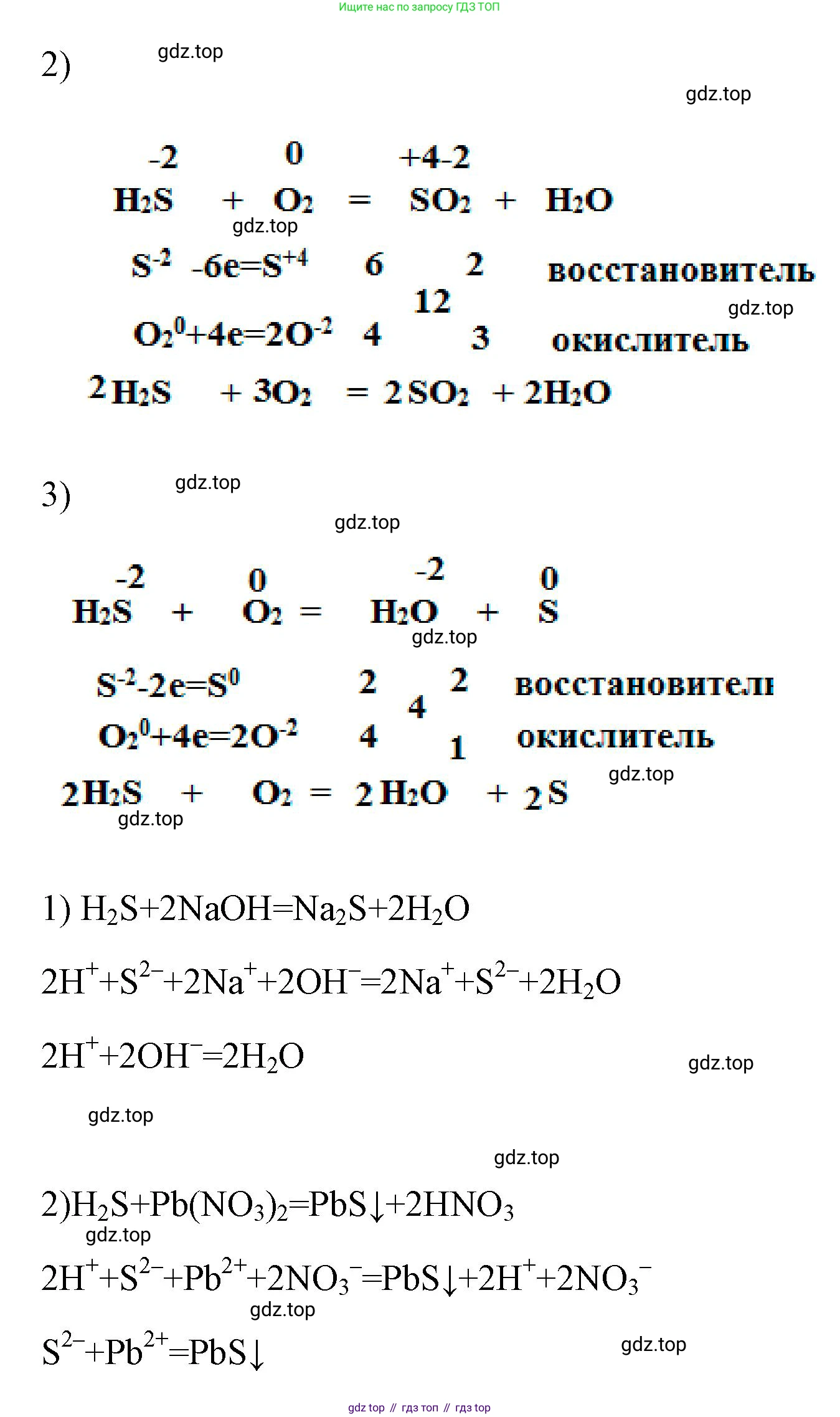
Решение 2. №3 (с. 58)
3. За счёт атома серы $H_2S$ проявляет только восстановительные свойства.
В молекуле сероводорода ($H_2S$) атом серы имеет свою низшую возможную степень окисления, равную -2. В ходе химических реакций сера может только повышать свою степень окисления (например, до 0, +4, +6), отдавая электроны. Процесс отдачи электронов называется окислением, а вещество, которое отдает электроны, является восстановителем. Поэтому сероводород в окислительно-восстановительных реакциях выступает исключительно в роли восстановителя.
Рассмотрите следующие окислительно-восстановительные реакции с позиций окисления-восстановления:
1) $H_2S + SO_2 =$
Решение:Это реакция сопропорционирования, в которой сера из двух разных степеней окисления переходит в одну. Сероводород ($H_2S$) является восстановителем (сера в степени окисления -2), а диоксид серы ($SO_2$) — окислителем (сера в степени окисления +4). В результате реакции образуется простое вещество сера (степень окисления 0) и вода.
Уравнение реакции:
$2H_2\stackrel{-2}{S} + \stackrel{+4}{S}O_2 = 3\stackrel{0}{S} \downarrow + 2H_2O$
Электронный баланс:
$\stackrel{-2}{S} - 2e^- \rightarrow \stackrel{0}{S}$ | 2 (окисление, $H_2S$ — восстановитель)
$\stackrel{+4}{S} + 4e^- \rightarrow \stackrel{0}{S}$ | 1 (восстановление, $SO_2$ — окислитель)
Ответ: $2H_2S + SO_2 = 3S + 2H_2O$
2) $H_2S + O_2$ (избыток) =
Решение:Это реакция полного сгорания сероводорода в избытке кислорода. Сера окисляется до оксида серы(IV). $H_2S$ — восстановитель, кислород ($O_2$) — окислитель.
Уравнение реакции:
$2\stackrel{-2}{H_2S} + 3\stackrel{0}{O_2} = 2\stackrel{+4}{S}\stackrel{-2}{O_2} + 2H_2\stackrel{-2}{O}$
Ответ: $2H_2S + 3O_2 = 2SO_2 + 2H_2O$
3) $H_2S + O_2$ (недостаток) =
Решение:Это реакция неполного сгорания сероводорода при недостатке кислорода. Сера окисляется до простого вещества. $H_2S$ — восстановитель, кислород ($O_2$) — окислитель.
Уравнение реакции:
$2\stackrel{-2}{H_2S} + \stackrel{0}{O_2} = 2\stackrel{0}{S} \downarrow + 2H_2O$
Ответ: $2H_2S + O_2 = 2S + 2H_2O$
Раствор сероводорода в воде проявляет свойства слабой кислоты. Запишите молекулярные и ионные уравнения следующих реакций:
1) $H_2S + NaOH =$
Решение:Сероводородная кислота является слабой двухосновной кислотой. При реакции с гидроксидом натрия в молярном соотношении 1:1 образуется кислая соль (гидросульфид натрия) и вода.
Молекулярное уравнение:
$H_2S + NaOH = NaHS + H_2O$
Полное ионное уравнение ($H_2S$ — слабая кислота, пишется в молекулярном виде; $NaOH$ — сильное основание; $NaHS$ — растворимая соль):
$H_2S + Na^+ + OH^- = Na^+ + HS^- + H_2O$
Сокращенное ионное уравнение (после сокращения ионов $Na^+$):
$H_2S + OH^- = HS^- + H_2O$
Ответ: Молекулярное уравнение: $H_2S + NaOH = NaHS + H_2O$. Сокращенное ионное уравнение: $H_2S + OH^- = HS^- + H_2O$.
2) $H_2S + Pb(NO_3)_2 =$
Решение:Это качественная реакция на сероводород и сульфид-ионы. В ходе реакции ионного обмена между слабой сероводородной кислотой и растворимой солью нитратом свинца(II) выпадает характерный чёрный осадок сульфида свинца(II), нерастворимый в кислотах.
Молекулярное уравнение:
$H_2S + Pb(NO_3)_2 = PbS \downarrow + 2HNO_3$
Полное ионное уравнение ($H_2S$ — слабая кислота; $Pb(NO_3)_2$ — растворимая соль; $PbS$ — нерастворимый осадок; $HNO_3$ — сильная кислота):
$H_2S + Pb^{2+} + 2NO_3^- = PbS \downarrow + 2H^+ + 2NO_3^-$
Сокращенное ионное уравнение (после сокращения ионов $NO_3^-$):
$H_2S + Pb^{2+} = PbS \downarrow + 2H^+$
Ответ: Молекулярное уравнение: $H_2S + Pb(NO_3)_2 = PbS \downarrow + 2HNO_3$. Сокращенное ионное уравнение: $H_2S + Pb^{2+} = PbS \downarrow + 2H^+$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 58 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 58), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















