Номер 3, страница 60 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §14. Сероводород и сульфиды. Часть 2 - номер 3, страница 60.
№3 (с. 60)
Условие. №3 (с. 60)
скриншот условия

3. Дополните схемы реакций. Расставьте коэффициенты с помощью метода электронного баланса.
а) $H_2S + Br_2 \rightarrow S + \underline{\hspace{2em}}$
б) $H_2S + H_2SO_4(\text{конц.}) \rightarrow SO_2 + \underline{\hspace{2em}}$
в) $H_2S + HNO_3(\text{конц.}) \rightarrow NO_2 + H_2SO_4 + \underline{\hspace{2em}}$
Решение. №3 (с. 60)

Решение 2. №3 (с. 60)
а) H₂S + Br₂ → S + ...
Решение:
В данной реакции сероводород ($H_2S$) выступает в роли восстановителя, а бром ($Br_2$) — в роли окислителя. Атом серы в сероводороде имеет степень окисления -2 и окисляется до элементарной серы со степенью окисления 0. Атомы брома в молекуле $Br_2$ имеют степень окисления 0 и восстанавливаются до бромид-ионов ($Br^{-1}$), которые с ионами водорода образуют бромоводород ($HBr$). Таким образом, недостающий продукт реакции — это $HBr$.
Полная схема реакции: $H_2S + Br_2 \rightarrow S + HBr$.
Для расстановки коэффициентов составим электронный баланс, определив процессы окисления и восстановления:
$S^{-2} - 2e^- \rightarrow S^0$ | 1 | — процесс окисления, $H_2S$ является восстановителем.
$Br_2^0 + 2e^- \rightarrow 2Br^{-1}$ | 1 | — процесс восстановления, $Br_2$ является окислителем.
Число отданных электронов равно числу принятых (2=2), поэтому коэффициенты перед веществами, содержащими серу и бром, равны 1. Ставим коэффициент 1 перед $H_2S$, $Br_2$ и $S$. Поскольку в процессе восстановления из одной молекулы $Br_2$ образуется два бромид-иона, перед $HBr$ ставим коэффициент 2.
Итоговое уравнение реакции:
$H_2S + Br_2 \rightarrow S + 2HBr$
Проверим баланс атомов: H: 2 слева, 2 справа; S: 1 слева, 1 справа; Br: 2 слева, 2 справа. Уравнение сбалансировано.
Ответ: $H_2S + Br_2 \rightarrow S + 2HBr$.
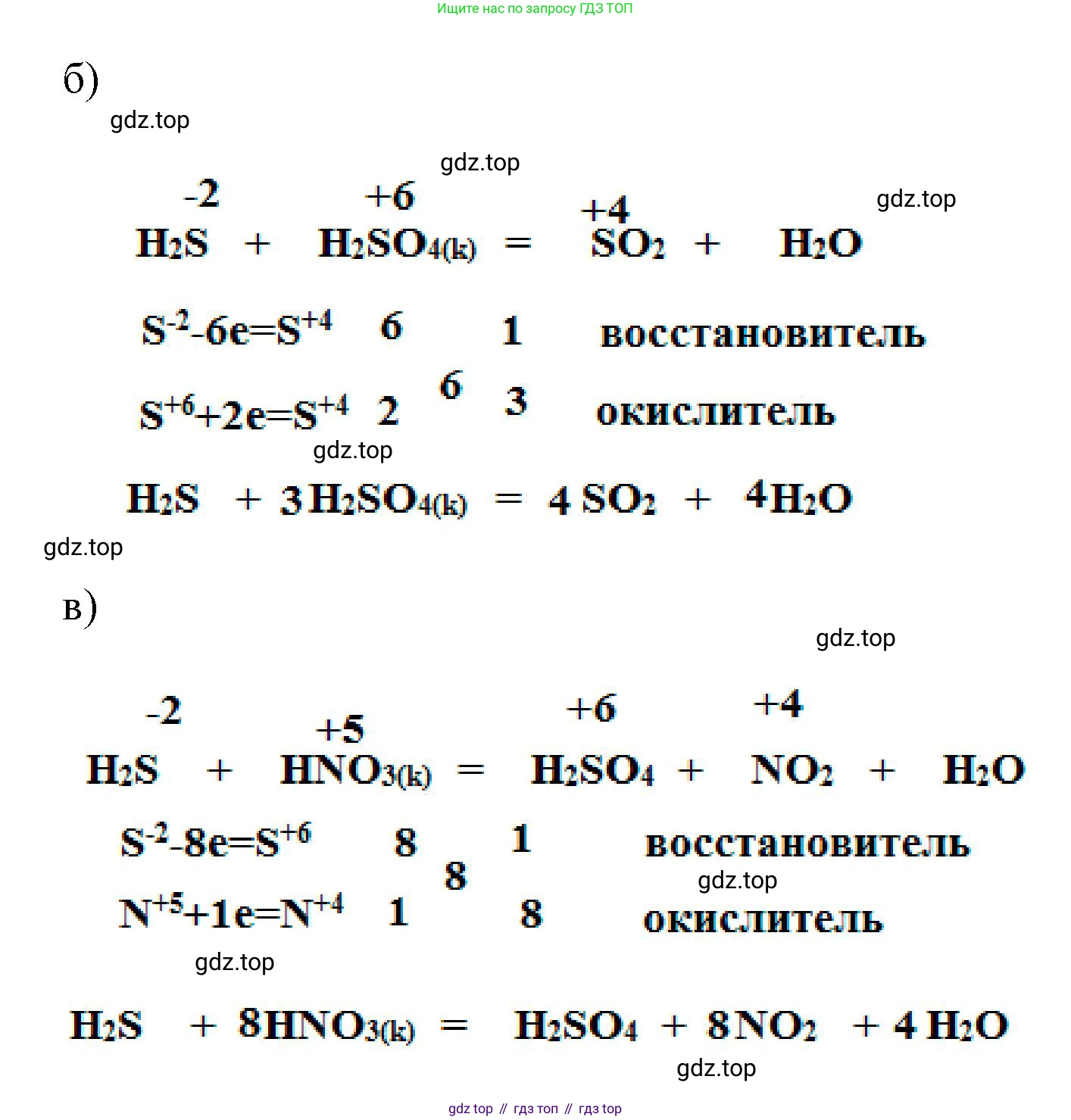
б) H₂S + H₂SO₄(конц.) → SO₂ + ...
Решение:
В этой окислительно-восстановительной реакции сероводород ($H_2S$) является восстановителем, а концентрированная серная кислота ($H_2SO_4$) — окислителем. В реакции участвует один и тот же элемент (сера) в разных степенях окисления: $S^{-2}$ в $H_2S$ и $S^{+6}$ в $H_2SO_4$. Сера из серной кислоты восстанавливается до $S^{+4}$ (в $SO_2$), а сера из сероводорода окисляется до $S^0$ (элементарная сера). Также в результате реакции образуется вода ($H_2O$).
Полная схема реакции: $H_2S + H_2SO_4 \rightarrow SO_2 + S + H_2O$.
Составим электронный баланс:
$S^{-2} - 2e^- \rightarrow S^0$ | 1 | — процесс окисления, $H_2S$ является восстановителем.
$S^{+6} + 2e^- \rightarrow S^{+4}$ | 1 | — процесс восстановления, $H_2SO_4$ является окислителем.
Количество отданных и принятых электронов равно, поэтому стехиометрические коэффициенты для $H_2S$ и $H_2SO_4$ равны 1. Это также означает, что коэффициенты перед $S$ и $SO_2$ тоже равны 1.
$1 \cdot H_2S + 1 \cdot H_2SO_4 \rightarrow 1 \cdot SO_2 + 1 \cdot S + H_2O$
Теперь уравняем число атомов водорода и кислорода. Слева: $2 + 2 = 4$ атома водорода. Справа, чтобы получить 4 атома водорода, ставим коэффициент 2 перед $H_2O$.
Проверим баланс атомов кислорода: слева 4 атома в $H_2SO_4$, справа $2$ в $SO_2$ и $2 \cdot 1 = 2$ в $2H_2O$, итого $2+2=4$. Баланс соблюден.
Итоговое уравнение реакции:
$H_2S + H_2SO_4(конц.) \rightarrow SO_2 + S + 2H_2O$
Ответ: $H_2S + H_2SO_4(конц.) \rightarrow SO_2 + S + 2H_2O$.
в) H₂S + HNO₃(конц.) → NO₂ + H₂SO₄ + ...
Решение:
Концентрированная азотная кислота ($HNO_3$) является очень сильным окислителем. В реакции с сероводородом ($H_2S$) она окисляет серу из степени окисления -2 до максимальной степени окисления +6, в результате чего образуется серная кислота ($H_2SO_4$). Азот в $HNO_3$ (степень окисления +5) восстанавливается до оксида азота(IV) $NO_2$ (степень окисления +4). Третьим продуктом реакции является вода ($H_2O$).
Полная схема реакции: $H_2S + HNO_3 \rightarrow NO_2 + H_2SO_4 + H_2O$.
Составим электронный баланс:
$S^{-2} - 8e^- \rightarrow S^{+6}$ | 1 | — процесс окисления, $H_2S$ является восстановителем.
$N^{+5} + 1e^- \rightarrow N^{+4}$ | 8 | — процесс восстановления, $HNO_3$ является окислителем.
Наименьшее общее кратное для чисел отданных и принятых электронов (8 и 1) равно 8. Таким образом, коэффициент перед соединениями серы ($H_2S$, $H_2SO_4$) равен 1, а перед соединениями азота ($HNO_3$, $NO_2$) равен 8.
$1 \cdot H_2S + 8 \cdot HNO_3 \rightarrow 8 \cdot NO_2 + 1 \cdot H_2SO_4 + H_2O$
Уравняем атомы водорода. Слева: $2$ в $H_2S$ и $8$ в $HNO_3$, итого 10. Справа: $2$ в $H_2SO_4$. Для баланса не хватает $10 - 2 = 8$ атомов водорода, что соответствует 4 молекулам воды ($4H_2O$).
Проверим баланс по кислороду. Слева: $8 \cdot 3 = 24$. Справа: $8 \cdot 2$ (в $NO_2$) $+ 4$ (в $H_2SO_4$) $+ 4 \cdot 1$ (в $H_2O$) $= 16 + 4 + 4 = 24$. Баланс соблюден.
Итоговое уравнение реакции:
$H_2S + 8HNO_3(конц.) \rightarrow 8NO_2 + H_2SO_4 + 4H_2O$
Ответ: $H_2S + 8HNO_3(конц.) \rightarrow 8NO_2 + H_2SO_4 + 4H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 60 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 60), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















