Номер 2, страница 115 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава IV. Металлы и их соединения. §29. Химические свойства металлов. Часть 1 - номер 2, страница 115.
№2 (с. 115)
Условие. №2 (с. 115)
скриншот условия
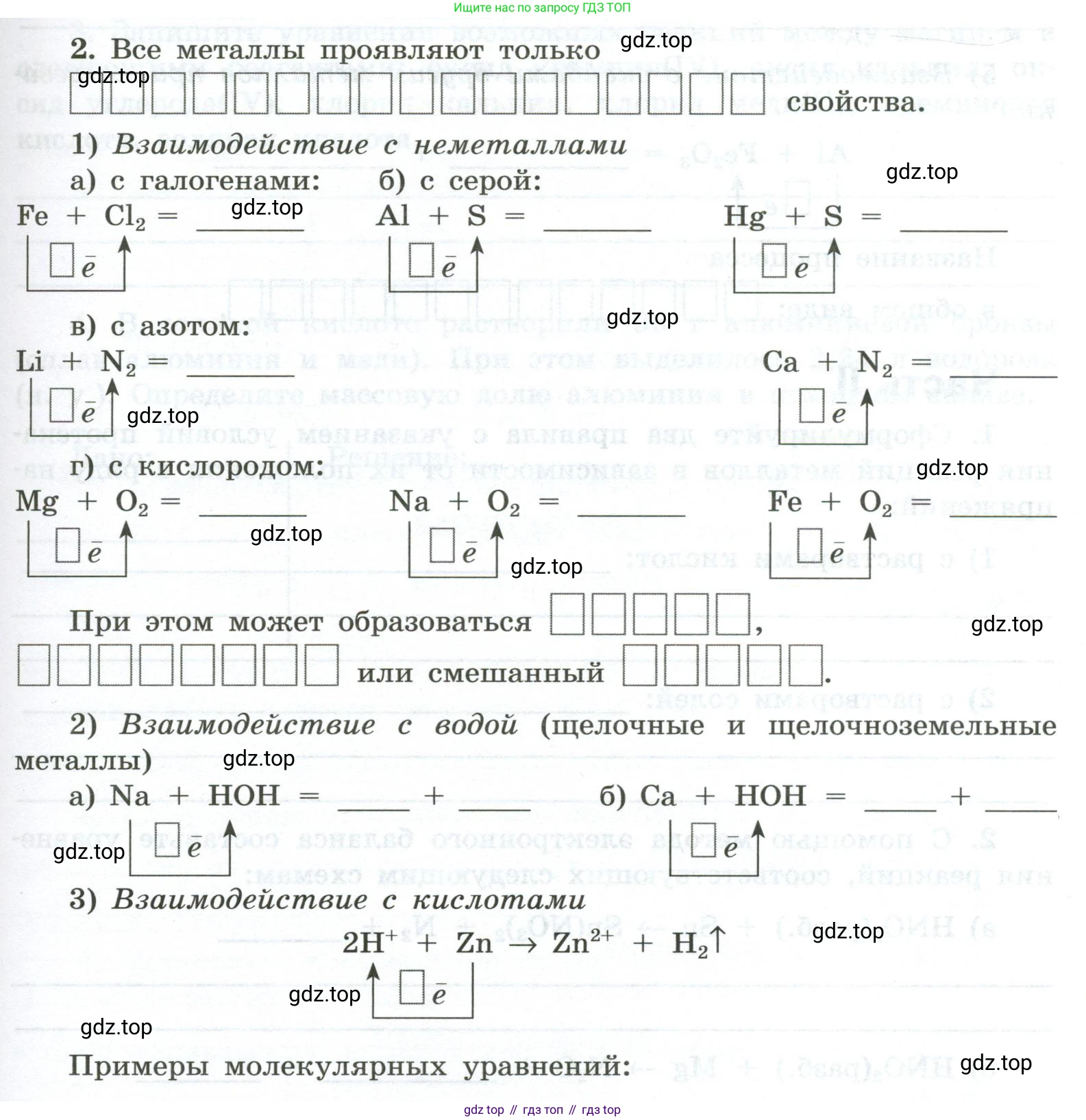

2. Все металлы проявляют только _________ свойства.
1) Взаимодействие с неметаллами
a) с галогенами:
$Fe + Cl_2 = \text{_____}$
$\boxed{\bar{e}}\uparrow$
б) с серой:
$Al + S = \text{_____}$
$\boxed{\bar{e}}\uparrow$
$Hg + S = \text{_____}$
$\boxed{\bar{e}}\uparrow$
в) с азотом:
$Li + N_2 = \text{_____}$
$\boxed{\bar{e}}\uparrow$
$Ca + N_2 = \text{_____}$
$\boxed{\bar{e}}\uparrow$
г) с кислородом:
$Mg + O_2 = \text{_____}$
$\boxed{\bar{e}}\uparrow$
$Na + O_2 = \text{_____}$
$\boxed{\bar{e}}\uparrow$
$Fe + O_2 = \text{_____}$
$\boxed{\bar{e}}\uparrow$
При этом может образоваться _________ , _________ или смешанный _________.
2) Взаимодействие с водой (щелочные и щелочноземельные металлы)
a) $Na + HOH = \text{_____} + \text{_____}$
$\boxed{\bar{e}}\uparrow$
б) $Ca + HOH = \text{_____} + \text{_____}$
$\boxed{\bar{e}}\uparrow$
3) Взаимодействие с кислотами
$2H^+ + Zn \rightarrow Zn^{2+} + H_2 \uparrow$
$\boxed{\bar{e}}\uparrow$
Примеры молекулярных уравнений:
4) Взаимодействие с растворами солей
$Cu^{2+} + Zn \rightarrow Zn^{2+} + Cu$
$\boxed{\bar{e}}\uparrow$
Примеры молекулярных уравнений:
5) Взаимодействие с оксидами других металлов при нагревании
$Al + Fe_2O_3 = \text{_____} + \text{_____}$
$\boxed{\bar{e}}\uparrow$
Название процесса _________
В общем виде: _________
Решение. №2 (с. 115)


Решение 2. №2 (с. 115)
Все металлы проявляют только восстановительные свойства.
Ответ: восстановительные.
1) Взаимодействие с неметаллами
а) с галогенами:
Железо реагирует с сильным окислителем хлором с образованием хлорида железа(III). В ходе реакции атом железа отдает 3 электрона, превращаясь в ион $Fe^{3+}$.
Уравнение: $2Fe + 3Cl_2 \xrightarrow{t} 2FeCl_3$.
Ответ: Уравнение: $2Fe + 3Cl_2 = 2FeCl_3$. Число в рамке: 3.
б) с серой:
Алюминий при нагревании реагирует с серой, образуя сульфид алюминия. Атом алюминия отдает 3 электрона.
Уравнение: $2Al + 3S \xrightarrow{t} Al_2S_3$.
Ответ: Уравнение: $2Al + 3S = Al_2S_3$. Число в рамке: 3.
Ртуть реагирует с серой при комнатной температуре, образуя сульфид ртути(II). Атом ртути отдает 2 электрона.
Уравнение: $Hg + S = HgS$.
Ответ: Уравнение: $Hg + S = HgS$. Число в рамке: 2.
в) с азотом:
Литий реагирует с азотом при комнатной температуре с образованием нитрида лития. Атом лития отдает 1 электрон.
Уравнение: $6Li + N_2 = 2Li_3N$.
Ответ: Уравнение: $6Li + N_2 = 2Li_3N$. Число в рамке: 1.
Кальций реагирует с азотом при нагревании, образуя нитрид кальция. Атом кальция отдает 2 электрона.
Уравнение: $3Ca + N_2 \xrightarrow{t} Ca_3N_2$.
Ответ: Уравнение: $3Ca + N_2 = Ca_3N_2$. Число в рамке: 2.
г) с кислородом:
Магний горит в кислороде, образуя оксид магния. Атом магния отдает 2 электрона.
Уравнение: $2Mg + O_2 = 2MgO$.
Ответ: Уравнение: $2Mg + O_2 = 2MgO$. Число в рамке: 2.
Натрий при горении в кислороде образует преимущественно пероксид натрия. Атом натрия отдает 1 электрон.
Уравнение: $2Na + O_2 = Na_2O_2$.
Ответ: Уравнение: $2Na + O_2 = Na_2O_2$. Число в рамке: 1.
Железо при горении в кислороде образует железную окалину $Fe_3O_4$ (смешанный оксид) или оксид железа(III) $Fe_2O_3$. В последнем случае атом железа отдает 3 электрона.
Уравнение: $4Fe + 3O_2 \xrightarrow{t} 2Fe_2O_3$.
Ответ: Уравнение: $4Fe + 3O_2 = 2Fe_2O_3$. Число в рамке: 3.
При взаимодействии металлов с кислородом могут образовываться оксиды (MgO), пероксиды ($Na_2O_2$) или смешанные оксиды ($Fe_3O_4$).
Ответ: оксид, пероксид, оксид.
2) Взаимодействие с водой (щелочные и щелочноземельные металлы)
а) Натрий бурно реагирует с водой с образованием гидроксида натрия и выделением водорода. Атом натрия отдает 1 электрон.
Уравнение: $2Na + 2HOH = 2NaOH + H_2 \uparrow$.
Ответ: Уравнение: $2Na + 2HOH = 2NaOH + H_2 \uparrow$. Число в рамке: 1.
б) Кальций реагирует с водой с образованием гидроксида кальция и выделением водорода. Атом кальция отдает 2 электрона.
Уравнение: $Ca + 2HOH = Ca(OH)_2 + H_2 \uparrow$.
Ответ: Уравнение: $Ca + 2HOH = Ca(OH)_2 + H_2 \uparrow$. Число в рамке: 2.
3) Взаимодействие с кислотами
Цинк, как металл, стоящий в ряду активности до водорода, вытесняет его из кислот, окисляясь до иона $Zn^{2+}$ и отдавая 2 электрона.
Ответ: Число в рамке: 2.
Пример молекулярного уравнения - реакция цинка с соляной кислотой:
$Zn + 2HCl = ZnCl_2 + H_2 \uparrow$.
Ответ: $Zn + 2HCl = ZnCl_2 + H_2 \uparrow$.
4) Взаимодействие с растворами солей
Более активный металл цинк вытесняет менее активную медь из раствора ее соли. При этом атом цинка отдает 2 электрона, окисляясь до $Zn^{2+}$.
Ответ: Число в рамке: 2.
Пример молекулярного уравнения - реакция цинка с сульфатом меди(II):
$Zn + CuSO_4 = ZnSO_4 + Cu$.
Ответ: $Zn + CuSO_4 = ZnSO_4 + Cu$.
5) Взаимодействие с оксидами других металлов при нагревании
Алюминий восстанавливает железо из его оксида, так как является более активным металлом. Атом алюминия отдает 3 электрона.
Уравнение: $2Al + Fe_2O_3 \xrightarrow{t} Al_2O_3 + 2Fe$.
Ответ: Уравнение: $2Al + Fe_2O_3 = Al_2O_3 + 2Fe$. Число в рамке: 3.
Название процесса, где в качестве восстановителя используется алюминий: Алюминотермия.
Ответ: Алюминотермия.
Общее название таких процессов, где металлы-восстановители (Al, Mg, Ca и др.) используются для получения других металлов из оксидов: металлотермия.
Ответ: металлотермия.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 115 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 115), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















