Номер 3, страница 127 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава IV. Металлы и их соединения. §32. Жёсткость воды и способы её устранения. Часть 2 - номер 3, страница 127.
№3 (с. 127)
Условие. №3 (с. 127)
скриншот условия

3. В одном литре воды содержится 225 мг хлорида кальция. Какая масса твёрдого мыла с формулой $C_{17}H_{35}COONa$ израсходуется, прежде чем оно начнёт мылиться и удалять грязь с белья?
Дано:
Решение:
Решение. №3 (с. 127)

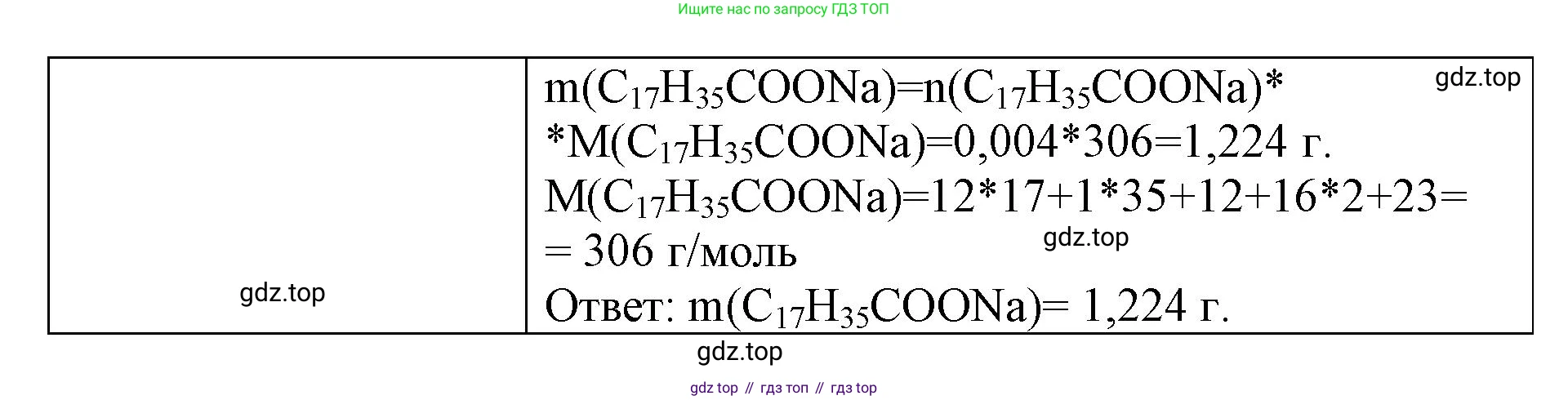
Решение 2. №3 (с. 127)
Дано:
$V(H_2O) = 1 \text{ л}$
$m(CaCl_2) = 225 \text{ мг}$
Формула мыла: $C_{17}H_{35}COONa$
Перевод в СИ:
$m(CaCl_2) = 225 \text{ мг} = 0.225 \text{ г}$
Найти:
$m(C_{17}H_{35}COONa) - ?$
Решение:
Мыло (стеарат натрия, $C_{17}H_{35}COONa$) не будет проявлять моющие свойства (мылиться) в жёсткой воде до тех пор, пока полностью не прореагирует с ионами кальция ($Ca^{2+}$), которые обуславливают жёсткость. В результате этой реакции образуется нерастворимый осадок — стеарат кальция. Мыло начнёт мылиться только после того, как все ионы кальция будут связаны в этот осадок.
1. Составим уравнение химической реакции между стеаратом натрия (мылом) и хлоридом кальция:
$2C_{17}H_{35}COONa + CaCl_2 \rightarrow (C_{17}H_{35}COO)_2Ca \downarrow + 2NaCl$
2. Рассчитаем молярные массы реагентов, используя значения относительных атомных масс из периодической таблицы (округлённые для удобства расчётов): $C \approx 12$, $H \approx 1$, $O \approx 16$, $Na \approx 23$, $Ca \approx 40$, $Cl \approx 35.5$.
Молярная масса хлорида кальция ($CaCl_2$):
$M(CaCl_2) = M(Ca) + 2 \times M(Cl) = 40 + 2 \times 35.5 = 111 \text{ г/моль}$
Молярная масса стеарата натрия ($C_{17}H_{35}COONa$):
$M(C_{17}H_{35}COONa) = 18 \times M(C) + 35 \times M(H) + 2 \times M(O) + M(Na) = 18 \times 12 + 35 \times 1 + 2 \times 16 + 23 = 216 + 35 + 32 + 23 = 306 \text{ г/моль}$
3. Найдём количество вещества (в молях) хлорида кальция, содержащегося в 1 литре воды.
$n(CaCl_2) = \frac{m(CaCl_2)}{M(CaCl_2)} = \frac{0.225 \text{ г}}{111 \text{ г/моль}} \approx 0.002027 \text{ моль}$
4. Согласно уравнению реакции, на 1 моль $CaCl_2$ расходуется 2 моль мыла ($C_{17}H_{35}COONa$). Определим количество вещества мыла, необходимое для реакции.
$n(C_{17}H_{35}COONa) = 2 \times n(CaCl_2) = 2 \times 0.002027 \text{ моль} \approx 0.004054 \text{ моль}$
5. Рассчитаем массу мыла, которая будет израсходована.
$m(C_{17}H_{35}COONa) = n(C_{17}H_{35}COONa) \times M(C_{17}H_{35}COONa)$
$m(C_{17}H_{35}COONa) = 0.004054 \text{ моль} \times 306 \text{ г/моль} \approx 1.24 \text{ г}$
Ответ: прежде чем мыло начнёт мылиться и удалять грязь, израсходуется 1.24 г твёрдого мыла.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 127 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 127), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















