Номер 13, страница 51 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
6. Галогены и их соединения. Упражнения и задачи для самостоятельного решения - номер 13, страница 51.
№13 (с. 51)
Условие. №13 (с. 51)
скриншот условия

13. Составьте уравнения реакций, которые могут протекать между следующими веществами: хлором ($Cl_2$), бромоводородной кислотой ($HBr$), перманганатом калия ($KMnO_4$), гидроксидом цинка ($Zn(OH)_2$). Окислительно-восстановительные реакции уравняйте с помощью метода электронного баланса, а реакции ионного обмена запишите в молекулярной, полной и сокращенной ионной форме.
Решение. №13 (с. 51)

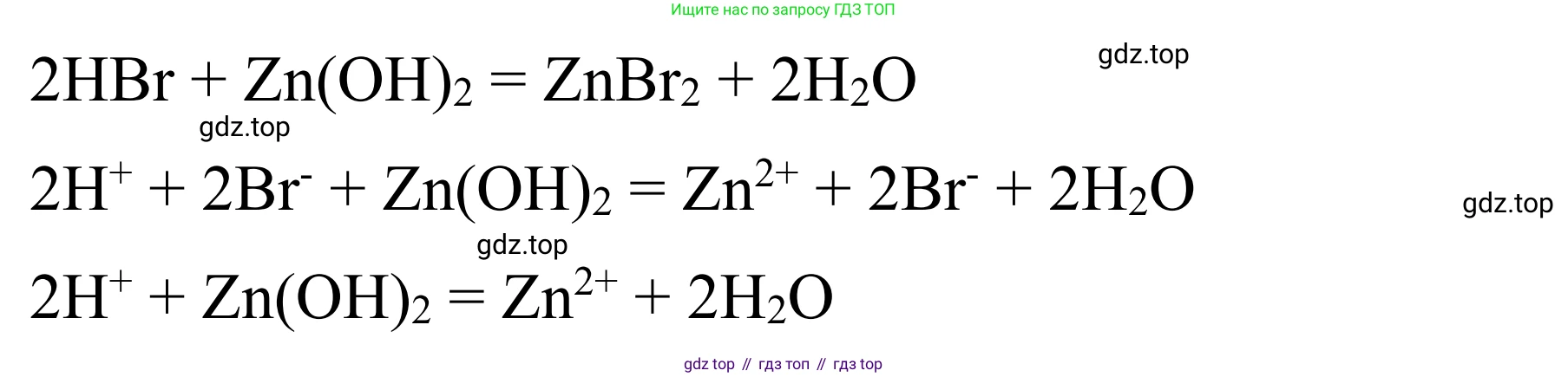
Решение 2. №13 (с. 51)
Проанализируем возможные взаимодействия между указанными веществами: хлором ($Cl_2$), бромоводородной кислотой ($HBr$), перманганатом калия ($KMnO_4$) и гидроксидом цинка ($Zn(OH)_2$). Возможны следующие реакции:
1. Взаимодействие хлора и бромоводородной кислоты
Решение
Хлор ($Cl_2$) является более активным галогеном, чем бром, поэтому он вытесняет бром из бромоводородной кислоты. Эта реакция является окислительно-восстановительной. Хлор выступает в роли окислителя, а бромид-ион ($Br^−$) — в роли восстановителя.
Составим схему реакции и определим степени окисления изменяющихся элементов:
$ \overset{0}{Cl_2} + H\overset{-1}{Br} \rightarrow H\overset{-1}{Cl} + \overset{0}{Br_2} $
Составим электронный баланс:
$ \begin{array}{l|l|l} Cl_2^0 + 2e^- \rightarrow 2Cl^{-1} & 1 & \text{окислитель, процесс восстановления} \\ 2Br^{-1} - 2e^- \rightarrow Br_2^0 & 1 & \text{восстановитель, процесс окисления} \\ \end{array} $
Коэффициенты в балансе равны 1, что позволяет нам уравнять исходное уравнение, поставив коэффициент 2 перед $HBr$ и $HCl$.
Ответ:
Молекулярное уравнение реакции:
$ Cl_2 + 2HBr \rightarrow 2HCl + Br_2 $
Электронный баланс:
$ \begin{array}{l|l} Cl_2^0 + 2e^- \rightarrow 2Cl^{-1} & 1 \\ 2Br^{-1} - 2e^- \rightarrow Br_2^0 & 1 \\ \end{array} $
2. Взаимодействие перманганата калия и бромоводородной кислоты
Решение
Перманганат калия ($KMnO_4$) — сильный окислитель (за счет $Mn^{+7}$), а бромоводородная кислота ($HBr$) — восстановитель (за счет $Br^{-1}$) и источник протонов ($H^+$) для создания кислой среды. Протекает окислительно-восстановительная реакция.
Схема реакции и степени окисления:
$ K\overset{+7}{Mn}O_4 + H\overset{-1}{Br} \rightarrow \overset{+2}{Mn}Br_2 + \overset{0}{Br_2} + KBr + H_2O $
Электронный баланс:
$ \begin{array}{l|l|l} Mn^{+7} + 5e^- \rightarrow Mn^{+2} & 2 & \text{окислитель, процесс восстановления} \\ 2Br^{-1} - 2e^- \rightarrow Br_2^0 & 5 & \text{восстановитель, процесс окисления} \\ \end{array} $
Используя коэффициенты из баланса, расставим их в уравнении. Ставим 2 перед $KMnO_4$ и $MnBr_2$, и 5 перед $Br_2$. Затем уравниваем остальные элементы: калий, бром, водород и кислород.
Итоговое уравнение:
$ 2KMnO_4 + 16HBr \rightarrow 2MnBr_2 + 5Br_2 + 2KBr + 8H_2O $
Ответ:
Молекулярное уравнение реакции:
$ 2KMnO_4 + 16HBr \rightarrow 2MnBr_2 + 5Br_2 + 2KBr + 8H_2O $
Электронный баланс:
$ \begin{array}{l|l} Mn^{+7} + 5e^- \rightarrow Mn^{+2} & 2 \\ 2Br^{-1} - 2e^- \rightarrow Br_2^0 & 5 \\ \end{array} $
3. Взаимодействие гидроксида цинка и бромоводородной кислоты
Решение
Гидроксид цинка ($Zn(OH)_2$) — нерастворимое в воде амфотерное основание. Он реагирует с сильной бромоводородной кислотой ($HBr$) в реакции ионного обмена (нейтрализации).
Молекулярная форма уравнения:
$ Zn(OH)_2 + 2HBr \rightarrow ZnBr_2 + 2H_2O $
Для написания ионных уравнений учтем, что $Zn(OH)_2$ — нерастворимое вещество (слабый электролит), $HBr$ — сильная кислота (сильный электролит), $ZnBr_2$ — растворимая соль (сильный электролит), а $H_2O$ — очень слабый электролит.
Полная ионная форма:
$ Zn(OH)_2(тв) + 2H^+ + 2Br^- \rightarrow Zn^{2+} + 2Br^- + 2H_2O $
Сокращенная ионная форма (после исключения ионов-наблюдателей $Br^-$):
$ Zn(OH)_2(тв) + 2H^+ \rightarrow Zn^{2+} + 2H_2O $
Ответ:
Молекулярное уравнение:
$ Zn(OH)_2 + 2HBr \rightarrow ZnBr_2 + 2H_2O $
Полное ионное уравнение:
$ Zn(OH)_2 + 2H^+ + 2Br^- \rightarrow Zn^{2+} + 2Br^- + 2H_2O $
Сокращенное ионное уравнение:
$ Zn(OH)_2 + 2H^+ \rightarrow Zn^{2+} + 2H_2O $
Примечание: Другие пары веществ ($Cl_2$ и $KMnO_4$; $Cl_2$ и $Zn(OH)_2$; $KMnO_4$ и $Zn(OH)_2$) в обычных условиях не реагируют, так как либо оба являются окислителями, либо отсутствует подходящий восстановитель/окислитель или среда.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 13 расположенного на странице 51 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №13 (с. 51), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.














