Номер 6, страница 50 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
6. Галогены и их соединения. Упражнения и задачи для самостоятельного решения - номер 6, страница 50.
№6 (с. 50)
Условие. №6 (с. 50)
скриншот условия


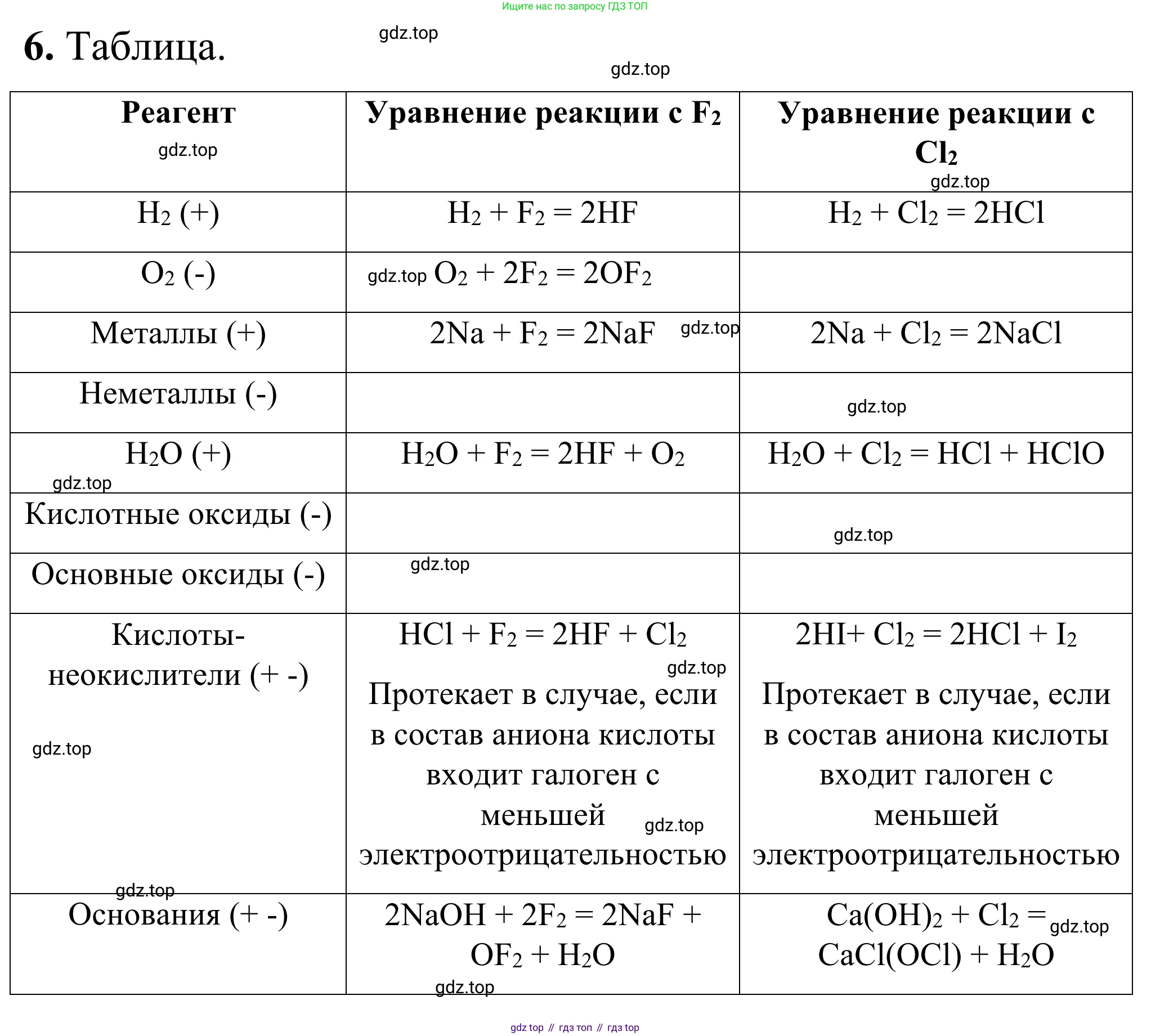
6. Заполните в тетради таблицу.
| Реагент | Уравнение реакции с $F_2$ | Уравнение реакции с $Cl_2$ |
|---|---|---|
| $H_2 (+)$ | ||
| $O_2 (-)$ | ||
| Металлы (+) | ||
| Неметаллы $(+ -)*$ | ||
| $H_2O (+)$ | ||
| Кислотные оксиды $(-)$ | ||
| Основные оксиды $(-)$ |
| Реагент | Уравнение реакции с $F_2$ | Уравнение реакции с $Cl_2$ |
|---|---|---|
| Кислоты-неокислители $(+ -)*$ | ||
| Основания $(+ -)*$ | ||
| Соли $(+ -)*$ |
* Если реакции протекают не всегда $(+ -)$, сформулируйте правила их протекания.
Решение. №6 (с. 50)

Решение 2. №6 (с. 50)
H₂ (+)
Водород активно реагирует и с фтором, и с хлором, образуя соответствующие галогеноводороды. Реакция с фтором протекает самопроизвольно со взрывом даже в темноте и при низких температурах. Реакция с хлором является цепной фотохимической реакцией и инициируется ультрафиолетовым излучением или нагреванием.
Уравнение реакции с F₂: $H_2 + F_2 \rightarrow 2HF$
Уравнение реакции с Cl₂: $H_2 + Cl_2 \xrightarrow{h\nu \text{ или } t} 2HCl$
Ответ: Уравнение реакции с F₂: $H_2 + F_2 \rightarrow 2HF$. Уравнение реакции с Cl₂: $H_2 + Cl_2 \xrightarrow{h\nu \text{ или } t} 2HCl$.
O₂ (-)Хлор не способен напрямую реагировать с кислородом. Фтор — единственный галоген, который непосредственно реагирует с кислородом, так как он является более электроотрицательным элементом. Реакция протекает в особых условиях (например, в электрическом разряде при охлаждении) с образованием фторидов кислорода. В таблице указан знак "(-)", что можно считать верным для стандартных условий.
Уравнение реакции с F₂: $2F_2 + O_2 \xrightarrow{\text{эл. разряд}} 2OF_2$
Уравнение реакции с Cl₂: Реакция не протекает.
Ответ: Уравнение реакции с F₂: $2F_2 + O_2 \xrightarrow{\text{эл. разряд}} 2OF_2$. С Cl₂ реакция не протекает.
Металлы (+)Фтор реагирует со всеми металлами, как правило, очень энергично и часто при комнатной температуре. Хлор также реагирует с большинством металлов (кроме благородных), но обычно при нагревании. В реакциях с переходными металлами галогены выступают как сильные окислители, переводя металл в высшую или высокую степень окисления (например, железо окисляется до +3). В качестве примера возьмем натрий.
Уравнение реакции с F₂: $2Na + F_2 \rightarrow 2NaF$
Уравнение реакции с Cl₂: $2Na + Cl_2 \xrightarrow{t} 2NaCl$
Ответ: Уравнение реакции с F₂ (на примере натрия): $2Na + F_2 \rightarrow 2NaF$. Уравнение реакции с Cl₂ (на примере натрия): $2Na + Cl_2 \xrightarrow{t} 2NaCl$.
Неметаллы (+ –)*Фтор, как самый сильный окислитель, реагирует почти со всеми неметаллами (кроме гелия, неона и аргона), окисляя их до высшей степени окисления. Хлор менее активен и реагирует со многими, но не со всеми неметаллами (не реагирует с O₂, N₂, C, благородными газами). В качестве примера возьмем фосфор.
Уравнение реакции с F₂: $2P + 5F_2 \rightarrow 2PF_5$
Уравнение реакции с Cl₂: $2P + 5Cl_2 \xrightarrow{t} 2PCl_5$ (в избытке хлора)
* Правило: Фтор реагирует почти со всеми неметаллами. Активность взаимодействия с хлором ниже: он реагирует с такими неметаллами, как фосфор, сера, кремний, но не реагирует с кислородом, азотом, углеродом и инертными газами. Реакции, как правило, требуют инициации (нагревание, облучение).
Ответ: Уравнение реакции с F₂ (на примере фосфора): $2P + 5F_2 \rightarrow 2PF_5$. Уравнение реакции с Cl₂ (на примере фосфора): $2P + 5Cl_2 \xrightarrow{t} 2PCl_5$.
H₂O (+)Фтор очень бурно реагирует с водой, окисляя кислород. Реакция необратима. Хлор также реагирует с водой, но эта реакция обратима и приводит к образованию смеси двух кислот — соляной и хлорноватистой ("хлорная вода").
Уравнение реакции с F₂: $2F_2 + 2H_2O \rightarrow 4HF + O_2$
Уравнение реакции с Cl₂: $Cl_2 + H_2O \rightleftharpoons HCl + HClO$
Ответ: Уравнение реакции с F₂: $2F_2 + 2H_2O \rightarrow 4HF + O_2$. Уравнение реакции с Cl₂: $Cl_2 + H_2O \rightleftharpoons HCl + HClO$.
Кислотные оксиды (–)Как правило, галогены не вступают в реакцию с кислотными оксидами. Фтор теоретически может вытеснять кислород из некоторых оксидов (например, $SiO_2$), но такие реакции нетипичны. Хлор, как менее активный галоген, с кислотными оксидами не реагирует.
Уравнение реакции с F₂: Реакция в общем случае не протекает.
Уравнение реакции с Cl₂: Реакция не протекает.
Ответ: Реакции с F₂ и Cl₂ в общем случае не протекают.
Основные оксиды (–)В обычных условиях галогены не реагируют с основными оксидами. Фтор может вытеснять кислород из оксидов, но это не является общей закономерностью. Хлор не реагирует с основными оксидами.
Уравнение реакции с F₂: Реакция в общем случае не протекает.
Уравнение реакции с Cl₂: Реакция не протекает.
Ответ: Реакции с F₂ и Cl₂ в общем случае не протекают.
Кислоты-неокислители (+ –)*Галогены могут вытеснять менее активные галогены из их бескислородных кислот. При взаимодействии с водными растворами кислот определяющей является реакция галогена с водой.
Уравнение реакции с F₂ (вытеснение хлора из хлороводорода): $F_2 + 2HCl \rightarrow 2HF + Cl_2$
Уравнение реакции с Cl₂ (вытеснение брома из бромоводорода): $Cl_2 + 2HBr \rightarrow 2HCl + Br_2$
* Правило: Более активный галоген вытесняет менее активный из его бескислородной кислоты. Активность галогенов как окислителей уменьшается в ряду $F_2 > Cl_2 > Br_2 > I_2$. С кислородсодержащими кислотами-неокислителями (например, разбавленной серной) реакции не идут.
Ответ: Уравнение реакции с F₂ (на примере HCl): $F_2 + 2HCl \rightarrow 2HF + Cl_2$. Уравнение реакции с Cl₂ (на примере HBr): $Cl_2 + 2HBr \rightarrow 2HCl + Br_2$.
Основания (+ –)*Галогены вступают в реакции диспропорционирования со щелочами. Продукты реакции хлора зависят от температуры. Фтор реагирует со щелочами иначе, в первую очередь из-за его бурной реакции с водой.
Уравнение реакции с F₂: $2F_2 + 4NaOH \rightarrow 4NaF + 2H_2O + O_2$
Уравнение реакции с Cl₂ (в холодном растворе): $Cl_2 + 2NaOH_{\text{(разб., хол.)}} \rightarrow NaCl + NaClO + H_2O$
* Правило: Галогены реагируют с водными растворами щелочей. В случае хлора продукты зависят от условий: на холоде образуется смесь хлорида и гипохлорита, а при нагревании — хлорида и хлората ($3Cl_2 + 6NaOH_{\text{(гор.)}} \rightarrow 5NaCl + NaClO_3 + 3H_2O$).
Ответ: Уравнение реакции с F₂: $2F_2 + 4NaOH \rightarrow 4NaF + 2H_2O + O_2$. Уравнение реакции с Cl₂ (на холоде): $Cl_2 + 2NaOH \rightarrow NaCl + NaClO + H_2O$.
Соли (+ –)*Более активные галогены вытесняют менее активные из растворов их солей (галогенидов).
Уравнение реакции с F₂ (вытеснение хлора из хлорида натрия): $F_2 + 2NaCl \rightarrow 2NaF + Cl_2$ (протекает в расплаве; в растворе фтор реагирует с водой)
Уравнение реакции с Cl₂ (вытеснение брома из бромида натрия): $Cl_2 + 2NaBr \rightarrow 2NaCl + Br_2$
* Правило: Более активный галоген вытесняет менее активный из раствора его соли-галогенида. Ряд активности: $F_2 > Cl_2 > Br_2 > I_2$. Хлор не может вытеснить фтор, но может вытеснить бром и иод.
Ответ: Уравнение реакции с F₂ (на примере NaCl): $F_2 + 2NaCl \rightarrow 2NaF + Cl_2$. Уравнение реакции с Cl₂ (на примере NaBr): $Cl_2 + 2NaBr \rightarrow 2NaCl + Br_2$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 6 расположенного на странице 50 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 50), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.














