Номер 2, страница 49 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
6. Галогены и их соединения. Упражнения и задачи для самостоятельного решения - номер 2, страница 49.
№2 (с. 49)
Условие. №2 (с. 49)
скриншот условия
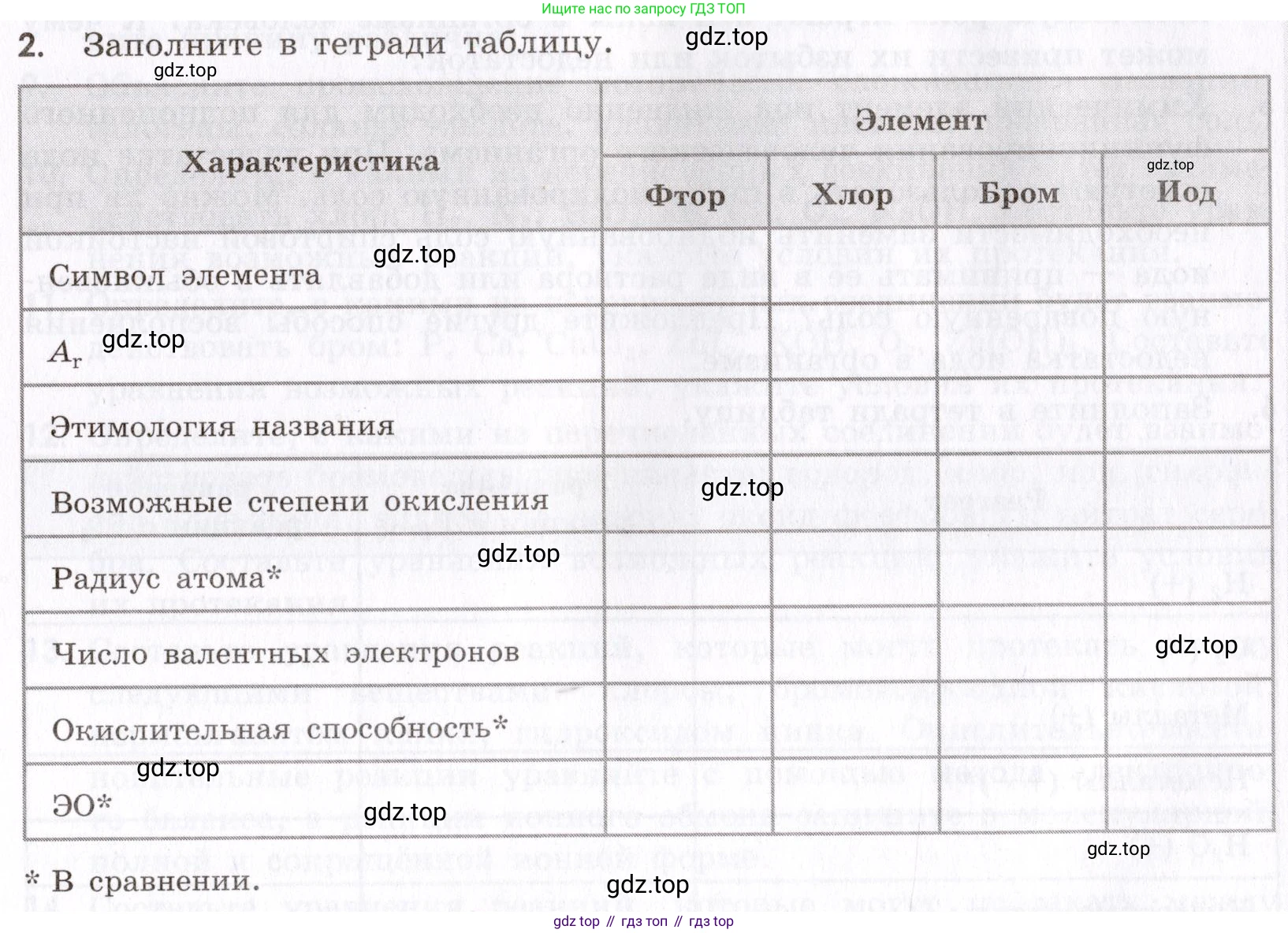
2. Заполните в тетради таблицу.
Характеристика
Элемент
Фтор
Хлор
Бром
Иод
Символ элемента
$A_r$
Этимология названия
Возможные степени окисления
Радиус атома*
Число валентных электронов
Окислительная способность*
ЭО*
* В сравнении.
Решение. №2 (с. 49)
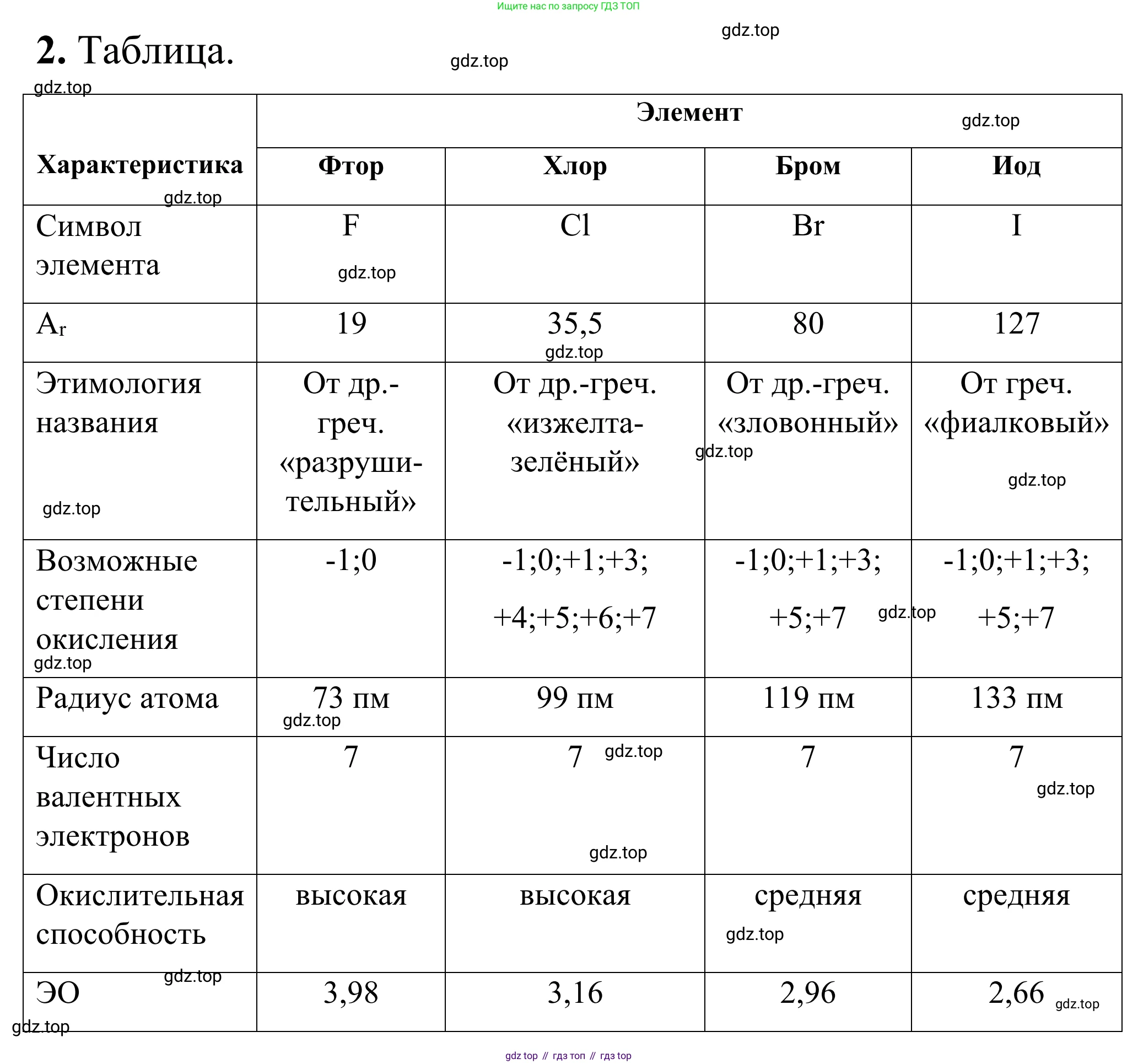
Решение 2. №2 (с. 49)
Символ элемента
Каждый химический элемент имеет уникальный одно- или двухбуквенный символ, который является сокращением его латинского названия.
Ответ: Фтор: F; Хлор: Cl; Бром: Br; Иод: I.
Ar
Относительная атомная масса, $A_r$, — это безразмерная величина, показывающая, во сколько раз масса атома элемента больше 1/12 массы атома углерода-12. Для практических расчетов значения обычно округляют.
Ответ: Фтор: $19$; Хлор: $35,5$; Бром: $80$; Иод: $127$.
Этимология названия
Названия галогенов происходят от древнегреческих слов, описывающих их характерные свойства: цвет, запах или реакционную способность.
Ответ: Фтор: от греч. φθόρος — «разрушение»; Хлор: от греч. χλωρός — «жёлто-зелёный»; Бром: от греч. βρῶμος — «зловоние»; Иод: от греч. ἰοειδής — «фиолетовый».
Возможные степени окисления
Степень окисления — это условный заряд атома в молекуле. Как правило, для галогенов характерна степень окисления $-1$. Однако все, кроме фтора, могут проявлять и положительные степени окисления в соединениях с более электроотрицательными элементами (например, кислородом). В простых веществах степень окисления равна нулю.
Ответ: Фтор: $0, -1$; Хлор: $-1, 0, +1, +3, +5, +7$; Бром: $-1, 0, +1, +3, +5, +7$; Иод: $-1, 0, +1, +3, +5, +7$.
Радиус атома*
В группе периодической системы с ростом порядкового номера (сверху вниз) радиус атомов увеличивается, так как увеличивается число электронных слоев.
Ответ: Радиус атома увеличивается в ряду $F < Cl < Br < I$.
Число валентных электронов
Все галогены расположены в 17-й (VIIA) группе периодической системы, поэтому все они имеют по 7 электронов на внешнем энергетическом уровне, которые и являются валентными (электронная конфигурация внешнего слоя $ns^2np^5$).
Ответ: У фтора, хлора, брома и иода по 7 валентных электронов.
Окислительная способность*
Окислительная способность простых веществ-галогенов уменьшается в группе сверху вниз. Это связано с увеличением радиуса атома и, как следствие, ослаблением способности атома принимать электроны. Фтор — самый сильный окислитель.
Ответ: Окислительная способность уменьшается в ряду $F > Cl > Br > I$.
ЭО*
Электроотрицательность (ЭО) — это способность атома в молекуле притягивать к себе электроны. В группе галогенов ЭО уменьшается сверху вниз с увеличением радиуса атома. Фтор — самый электроотрицательный элемент в периодической системе.
Ответ: Электроотрицательность уменьшается в ряду $F > Cl > Br > I$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 49 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 49), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















