Номер 20, страница 77 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
8. Азот, фосфор и их соединения. Упражнения и задачи для самостоятельного решения - номер 20, страница 77.
№20 (с. 77)
Условие. №20 (с. 77)
скриншот условия

20. Закончите схемы химических реакций, расставьте в них коэффициенты с помощью метода электронного баланса.
а) $NO_2 + NaOH \rightarrow$
б) $CuO + NH_3 \rightarrow$
в) $N_2 + Ba \rightarrow$
г) $NO + O_2 \rightarrow$
д) $KNO_2 + KMnO_4 + HCl \rightarrow$
Решение. №20 (с. 77)
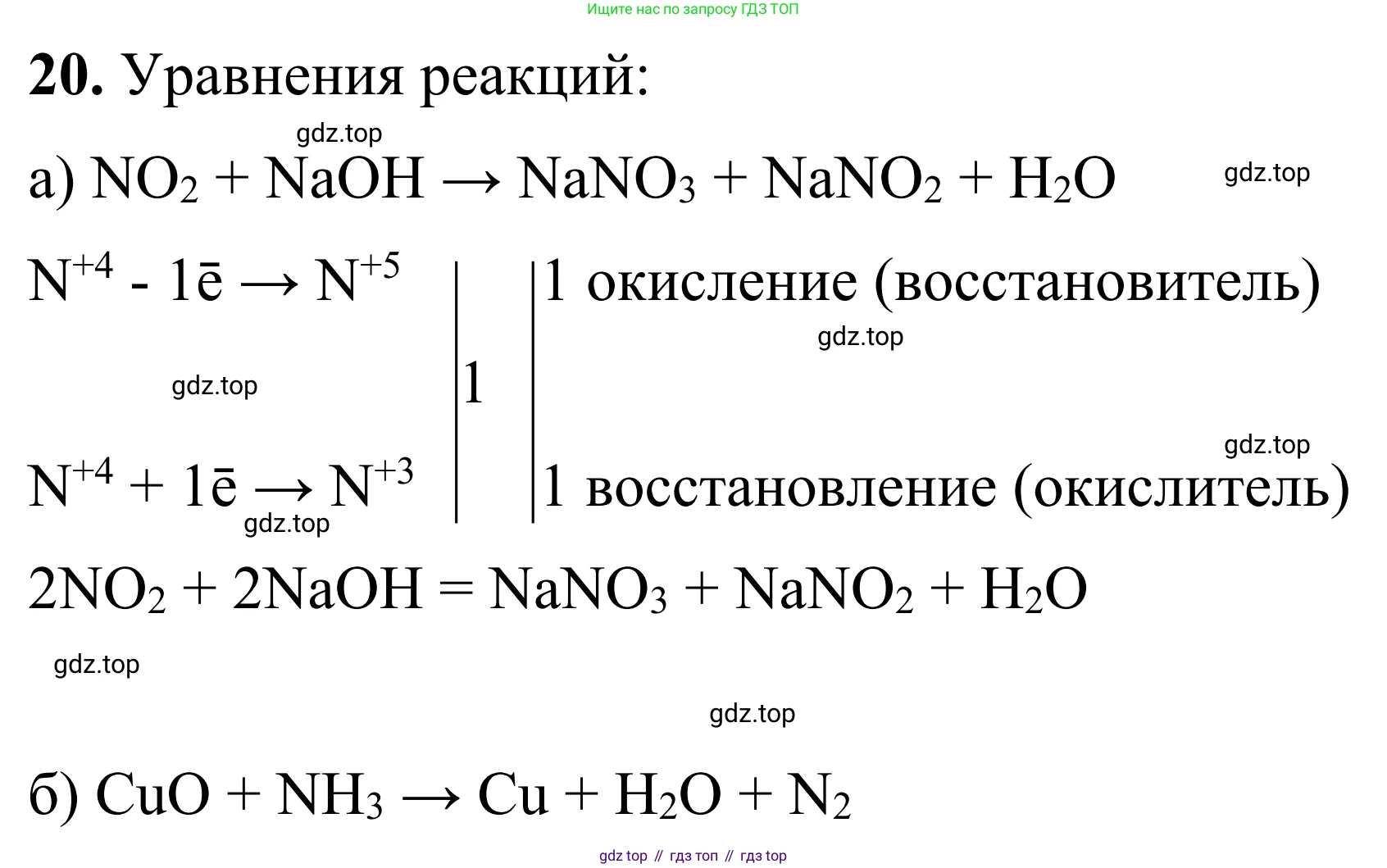

Решение 2. №20 (с. 77)
а) $NO_2 + NaOH \rightarrow$
Решение:
Это реакция диспропорционирования, в которой оксид азота(IV) реагирует со щелочью. Азот в степени окисления +4 одновременно и окисляется до +5, и восстанавливается до +3. Продуктами реакции являются нитрат натрия, нитрит натрия и вода.
Уравнение реакции в общем виде: $NO_2 + NaOH \rightarrow NaNO_3 + NaNO_2 + H_2O$.
Определим степени окисления элементов, которые их изменяют:
$N^{+4}O_2 + NaOH \rightarrow NaN^{+5}O_3 + NaN^{+3}O_2 + H_2O$
Составим электронный баланс:
$N^{+4} - 1e^- \rightarrow N^{+5}$ | 1 | процесс окисления
$N^{+4} + 1e^- \rightarrow N^{+3}$ | 1 | процесс восстановления
Число отданных и принятых электронов равно, поэтому коэффициенты перед веществами, содержащими азот в степенях окисления +5 и +3, равны 1. Это означает, что на 1 молекулу $NaNO_3$ образуется 1 молекула $NaNO_2$. Суммарно в продуктах 2 атома азота, значит, в левой части уравнения перед $NO_2$ ставим коэффициент 2.
$2NO_2 + NaOH \rightarrow NaNO_3 + NaNO_2 + H_2O$
Уравняем количество атомов натрия (Na). Справа 1+1=2 атома, значит, слева перед $NaOH$ ставим коэффициент 2.
$2NO_2 + 2NaOH \rightarrow NaNO_3 + NaNO_2 + H_2O$
Проверяем по водороду и кислороду. Слева: 2 H, 4+2=6 O. Справа: 2 H, 3+2+1=6 O. Уравнение сбалансировано.
Ответ: $2NO_2 + 2NaOH \rightarrow NaNO_3 + NaNO_2 + H_2O$.
б) $CuO + NH_3 \rightarrow$
Решение:
Это окислительно-восстановительная реакция, в которой оксид меди(II) ($CuO$) выступает в роли окислителя, а аммиак ($NH_3$) — в роли восстановителя. При нагревании медь восстанавливается до металлической, а азот в аммиаке окисляется до молекулярного азота $N_2$.
Уравнение реакции в общем виде: $CuO + NH_3 \rightarrow Cu + N_2 + H_2O$.
Определим степени окисления изменяющихся элементов:
$Cu^{+2}O + N^{-3}H_3 \rightarrow Cu^0 + N_2^0 + H_2O$
Составим электронный баланс:
$Cu^{+2} + 2e^- \rightarrow Cu^0$ | 3 | окислитель, процесс восстановления
$2N^{-3} - 6e^- \rightarrow N_2^0$ | 1 | восстановитель, процесс окисления
Наименьшее общее кратное (НОК) для чисел электронов 2 и 6 равно 6. Отсюда находим коэффициенты: для меди — 3, для азота — 1 (для $N_2$) и 2 (для $NH_3$).
Подставим коэффициенты в уравнение:
$3CuO + 2NH_3 \rightarrow 3Cu + N_2 + H_2O$
Уравняем количество атомов кислорода. Слева 3 атома, значит, справа перед $H_2O$ ставим коэффициент 3.
$3CuO + 2NH_3 \rightarrow 3Cu + N_2 + 3H_2O$
Проверяем по водороду. Слева: 2*3=6 H. Справа: 3*2=6 H. Уравнение сбалансировано.
Ответ: $3CuO + 2NH_3 \rightarrow 3Cu + N_2 + 3H_2O$.
в) $N_2 + Ba \rightarrow$
Решение:
Это реакция соединения, в которой активный металл барий ($Ba$) реагирует с азотом ($N_2$) при нагревании с образованием нитрида бария ($Ba_3N_2$).
Определим степени окисления:
$N_2^0 + Ba^0 \rightarrow Ba_3^{+2}N_2^{-3}$
Составим электронный баланс:
$N_2^0 + 6e^- \rightarrow 2N^{-3}$ | 1 | окислитель, процесс восстановления
$Ba^0 - 2e^- \rightarrow Ba^{+2}$ | 3 | восстановитель, процесс окисления
НОК(6, 2) = 6. Коэффициент для азота — 1, для бария — 3.
Подставим коэффициенты в уравнение:
$N_2 + 3Ba \rightarrow Ba_3N_2$
Проверка: слева 2 N, 3 Ba; справа 2 N, 3 Ba. Уравнение сбалансировано.
Ответ: $N_2 + 3Ba \xrightarrow{t} Ba_3N_2$.
г) $NO + O_2 \rightarrow$
Решение:
Это реакция соединения, в которой оксид азота(II) ($NO$) легко окисляется кислородом воздуха до оксида азота(IV) ($NO_2$).
Определим степени окисления:
$N^{+2}O + O_2^0 \rightarrow N^{+4}O_2^{-2}$
Составим электронный баланс:
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 1 | окислитель, процесс восстановления
$N^{+2} - 2e^- \rightarrow N^{+4}$ | 2 | восстановитель, процесс окисления
НОК(4, 2) = 4. Коэффициент для кислорода ($O_2$) — 1, для азота — 2.
Подставим коэффициенты в уравнение:
$2NO + O_2 \rightarrow 2NO_2$
Проверка: слева 2 N, 2+2=4 O; справа 2 N, 2*2=4 O. Уравнение сбалансировано.
Ответ: $2NO + O_2 \rightarrow 2NO_2$.
д) $KNO_2 + KMnO_4 + HCl \rightarrow$
Решение:
Это окислительно-восстановительная реакция в кислой среде. Перманганат калия ($KMnO_4$) — сильный окислитель, нитрит калия ($KNO_2$) — восстановитель. В кислой среде ($HCl$) марганец восстанавливается до $Mn^{+2}$, а азот окисляется до $N^{+5}$.
Уравнение реакции в общем виде: $KNO_2 + KMnO_4 + HCl \rightarrow KNO_3 + MnCl_2 + KCl + H_2O$.
Определим степени окисления изменяющихся элементов:
$KN^{+3}O_2 + KMn^{+7}O_4 + HCl \rightarrow KN^{+5}O_3 + Mn^{+2}Cl_2 + KCl + H_2O$
Составим электронный баланс:
$Mn^{+7} + 5e^- \rightarrow Mn^{+2}$ | 2 | окислитель, процесс восстановления
$N^{+3} - 2e^- \rightarrow N^{+5}$ | 5 | восстановитель, процесс окисления
НОК(5, 2) = 10. Коэффициент для марганца — 2, для азота — 5.
Подставим коэффициенты перед веществами с Mn и N:
$5KNO_2 + 2KMnO_4 + HCl \rightarrow 5KNO_3 + 2MnCl_2 + KCl + H_2O$
Уравняем калий (K). Слева 5+2=7 атомов K. Справа 5 атомов в $KNO_3$, значит, перед $KCl$ нужен коэффициент 2.
$5KNO_2 + 2KMnO_4 + HCl \rightarrow 5KNO_3 + 2MnCl_2 + 2KCl + H_2O$
Уравняем хлор (Cl). Справа 2*2 (в $MnCl_2$) + 2*1 (в $KCl$) = 6 атомов Cl. Значит, перед $HCl$ слева ставим коэффициент 6.
$5KNO_2 + 2KMnO_4 + 6HCl \rightarrow 5KNO_3 + 2MnCl_2 + 2KCl + H_2O$
Уравняем водород (H). Слева 6 атомов H. Чтобы получить 6 атомов H справа, ставим коэффициент 3 перед $H_2O$.
$5KNO_2 + 2KMnO_4 + 6HCl \rightarrow 5KNO_3 + 2MnCl_2 + 2KCl + 3H_2O$
Проверяем по кислороду (O). Слева: 5*2 + 2*4 = 10 + 8 = 18. Справа: 5*3 + 3*1 = 15 + 3 = 18. Уравнение сбалансировано.
Ответ: $5KNO_2 + 2KMnO_4 + 6HCl \rightarrow 5KNO_3 + 2MnCl_2 + 2KCl + 3H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 20 расположенного на странице 77 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №20 (с. 77), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















