Номер 22, страница 78 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
8. Азот, фосфор и их соединения. Упражнения и задачи для самостоятельного решения - номер 22, страница 78.
№22 (с. 78)
Условие. №22 (с. 78)
скриншот условия

22. Закончите уравнения реакций, расставьте коэффициенты с помощью метода электронного баланса.
а) концентрированная $HNO_3$ + $C$ =
б) разбавленная $HNO_3$ + $Cu$ =
в) разбавленная $HNO_3$ + $Ca$ =
г) концентрированная $HNO_3$ + $Ag$ =
д) разбавленная $HNO_3$ + $P$ =
е) очень разбавленная $HNO_3$ + $Na$ =
ж) концентрированная $HNO_3$ + $K$ =
Решение. №22 (с. 78)
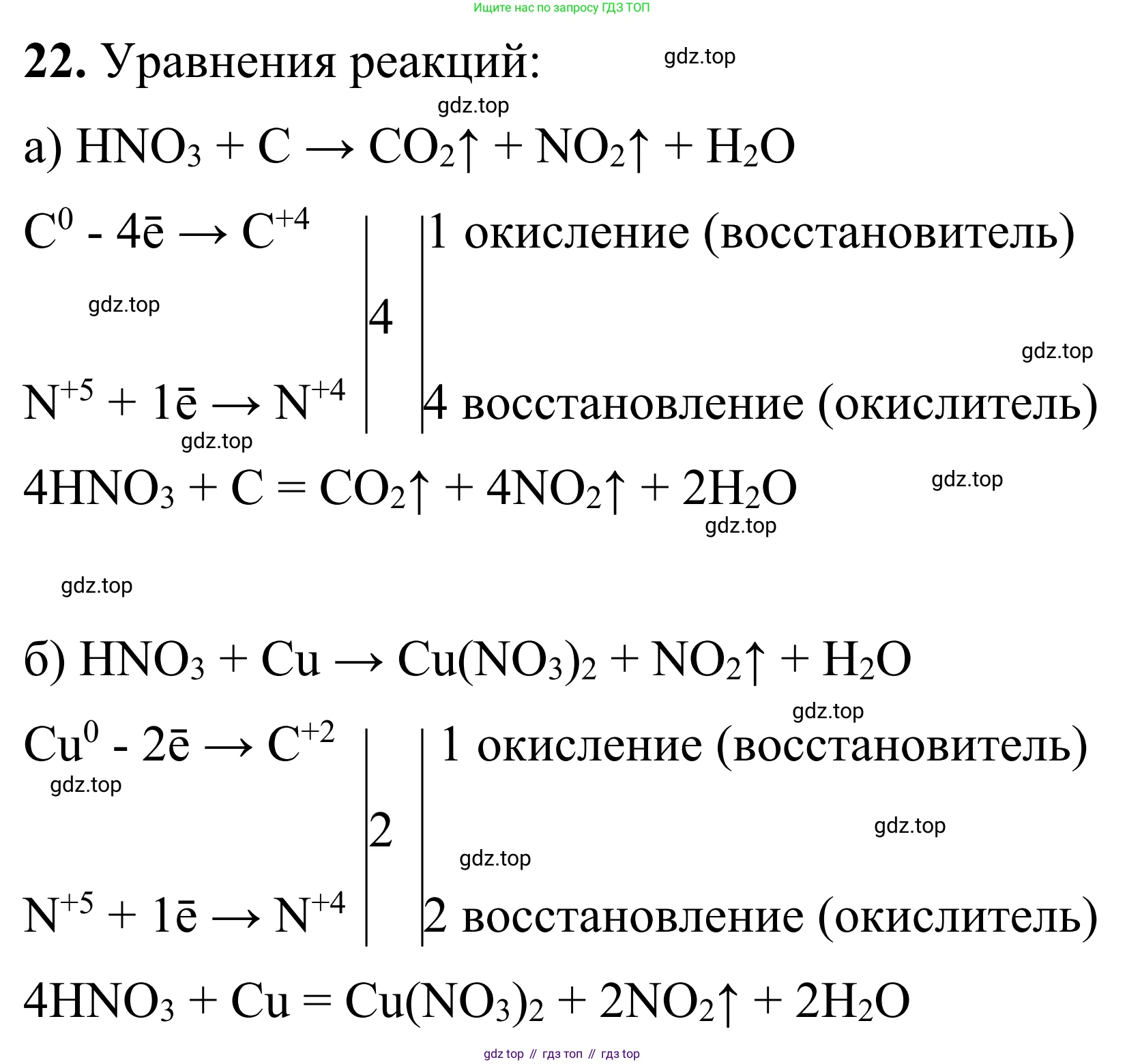

Решение 2. №22 (с. 78)
а) концентрированная азотная кислота + углерод
Решение:
При взаимодействии неметалла (углерода) с концентрированной азотной кислотой углерод окисляется до высшей степени окисления +4 (образуя $CO_2$), а азот из азотной кислоты восстанавливается до степени окисления +4 (образуя диоксид азота $NO_2$).
Схема окислительно-восстановительной реакции:
$C^0 + H\overset{+5}{N}O_3 \rightarrow \overset{+4}{C}O_2 + \overset{+4}{N}O_2 + H_2O$
Составим электронный баланс, чтобы определить коэффициенты:
$C^0 - 4e^- \rightarrow C^{+4} \quad | \ 1 \quad$ (процесс окисления, C – восстановитель)
$N^{+5} + 1e^- \rightarrow N^{+4} \quad | \ 4 \quad$ (процесс восстановления, $N^{+5}$ – окислитель)
Наименьшее общее кратное для отданных и принятых электронов равно 4. Расставляем коэффициенты. Перед формулами соединений углерода ставим 1 (обычно не пишется), а перед формулой диоксида азота – 4.
$C + HNO_3 \rightarrow CO_2 + 4NO_2 + H_2O$
Теперь уравниваем количество атомов азота в левой части уравнения. Справа у нас 4 атома азота в $NO_2$, значит, слева нужно 4 молекулы $HNO_3$.
$C + 4HNO_3 \rightarrow CO_2 + 4NO_2 + H_2O$
Уравниваем атомы водорода: слева их 4, значит, справа перед $H_2O$ ставим коэффициент 2.
$C + 4HNO_3 \rightarrow CO_2 + 4NO_2 + 2H_2O$
Проверяем баланс по кислороду: слева $4 \cdot 3 = 12$ атомов, справа $2 + 4 \cdot 2 + 2 \cdot 1 = 12$ атомов. Коэффициенты расставлены верно.
Ответ: $C + 4HNO_3(\text{конц.}) = CO_2 \uparrow + 4NO_2 \uparrow + 2H_2O$
б) разбавленная азотная кислота + медь
Решение:
Медь — металл средней активности, стоящий в ряду напряжений после водорода. С разбавленной азотной кислотой она реагирует с образованием нитрата меди(II) ($Cu(NO_3)_2$), оксида азота(II) ($NO$) и воды.
Схема окислительно-восстановительной реакции:
$\overset{0}{Cu} + H\overset{+5}{N}O_3 \rightarrow \overset{+2}{Cu}(NO_3)_2 + \overset{+2}{N}O + H_2O$
Составим электронный баланс:
$Cu^0 - 2e^- \rightarrow Cu^{+2} \quad | \ 3 \quad$ (окисление, Cu – восстановитель)
$N^{+5} + 3e^- \rightarrow N^{+2} \quad | \ 2 \quad$ (восстановление, $N^{+5}$ – окислитель)
Ставим коэффициент 3 перед соединениями меди и 2 перед оксидом азота(II).
$3Cu + HNO_3 \rightarrow 3Cu(NO_3)_2 + 2NO + H_2O$
Считаем атомы азота справа: в $3Cu(NO_3)_2$ их $3 \cdot 2 = 6$, и в $2NO$ их 2. Всего $6 + 2 = 8$ атомов. Значит, слева нужно 8 молекул $HNO_3$.
$3Cu + 8HNO_3 \rightarrow 3Cu(NO_3)_2 + 2NO + H_2O$
Уравниваем водород: слева 8 атомов, ставим коэффициент 4 перед $H_2O$.
$3Cu + 8HNO_3 \rightarrow 3Cu(NO_3)_2 + 2NO + 4H_2O$
Проверка по кислороду: слева $8 \cdot 3 = 24$, справа $3 \cdot 2 \cdot 3 + 2 + 4 = 18 + 2 + 4 = 24$. Баланс верный.
Ответ: $3Cu + 8HNO_3(\text{разб.}) = 3Cu(NO_3)_2 + 2NO \uparrow + 4H_2O$
в) разбавленная азотная кислота + кальций
Решение:
Кальций — активный щелочноземельный металл. При реакции с разбавленной азотной кислотой азот может восстанавливаться до $N_2O$. Образуются нитрат кальция ($Ca(NO_3)_2$), оксид азота(I) ($N_2O$) и вода.
Схема окислительно-восстановительной реакции:
$\overset{0}{Ca} + H\overset{+5}{N}O_3 \rightarrow \overset{+2}{Ca}(NO_3)_2 + \overset{+1}{N_2}O + H_2O$
Составим электронный баланс:
$Ca^0 - 2e^- \rightarrow Ca^{+2} \quad | \ 4 \quad$ (окисление, Ca – восстановитель)
$2N^{+5} + 8e^- \rightarrow 2N^{+1} \quad | \ 1 \quad$ (восстановление, $N^{+5}$ – окислитель)
Ставим коэффициент 4 перед соединениями кальция и 1 перед $N_2O$.
$4Ca + HNO_3 \rightarrow 4Ca(NO_3)_2 + N_2O + H_2O$
Считаем азот справа: в $4Ca(NO_3)_2$ его $4 \cdot 2 = 8$ атомов, в $N_2O$ — 2 атома. Всего $8 + 2 = 10$. Ставим 10 перед $HNO_3$.
$4Ca + 10HNO_3 \rightarrow 4Ca(NO_3)_2 + N_2O + H_2O$
Уравниваем водород: слева 10 атомов, значит, справа нужно 5 молекул воды.
$4Ca + 10HNO_3 \rightarrow 4Ca(NO_3)_2 + N_2O + 5H_2O$
Проверка по кислороду: слева $10 \cdot 3 = 30$, справа $4 \cdot 2 \cdot 3 + 1 + 5 = 24 + 1 + 5 = 30$. Баланс верный.
Ответ: $4Ca + 10HNO_3(\text{разб.}) = 4Ca(NO_3)_2 + N_2O \uparrow + 5H_2O$
г) концентрированная азотная кислота + серебро
Решение:
Серебро — малоактивный металл. С концентрированной азотной кислотой оно реагирует с образованием нитрата серебра(I) ($AgNO_3$), диоксида азота ($NO_2$) и воды.
Схема окислительно-восстановительной реакции:
$\overset{0}{Ag} + H\overset{+5}{N}O_3 \rightarrow \overset{+1}{Ag}NO_3 + \overset{+4}{N}O_2 + H_2O$
Составим электронный баланс:
$Ag^0 - 1e^- \rightarrow Ag^{+1} \quad | \ 1 \quad$ (окисление, Ag – восстановитель)
$N^{+5} + 1e^- \rightarrow N^{+4} \quad | \ 1 \quad$ (восстановление, $N^{+5}$ – окислитель)
Коэффициенты из баланса равны 1. Ставим 1 перед $Ag$ и $NO_2$.
$Ag + HNO_3 \rightarrow AgNO_3 + NO_2 + H_2O$
Считаем азот справа: 1 атом в $AgNO_3$ и 1 атом в $NO_2$. Всего 2 атома. Ставим 2 перед $HNO_3$.
$Ag + 2HNO_3 \rightarrow AgNO_3 + NO_2 + H_2O$
Уравниваем водород: слева 2 атома, значит, справа нужна 1 молекула воды (коэффициент 1 не пишется).
$Ag + 2HNO_3 \rightarrow AgNO_3 + NO_2 + H_2O$
Проверка по кислороду: слева $2 \cdot 3 = 6$, справа $3 + 2 + 1 = 6$. Баланс верный.
Ответ: $Ag + 2HNO_3(\text{конц.}) = AgNO_3 + NO_2 \uparrow + H_2O$
д) разбавленная азотная кислота + фосфор
Решение:
Фосфор, как и другие неметаллы, окисляется азотной кислотой до соответствующей кислоты в высшей степени окисления. Для фосфора это ортофосфорная кислота $H_3PO_4$. Азот в разбавленной кислоте восстанавливается до $NO$.
Схема окислительно-восстановительной реакции:
$\overset{0}{P} + H\overset{+5}{N}O_3 + H_2O \rightarrow H_3\overset{+5}{P}O_4 + \overset{+2}{N}O$
Составим электронный баланс:
$P^0 - 5e^- \rightarrow P^{+5} \quad | \ 3 \quad$ (окисление, P – восстановитель)
$N^{+5} + 3e^- \rightarrow N^{+2} \quad | \ 5 \quad$ (восстановление, $N^{+5}$ – окислитель)
Ставим коэффициент 3 перед соединениями фосфора и 5 перед $NO$.
$3P + 5HNO_3 + H_2O \rightarrow 3H_3PO_4 + 5NO$
Азот уравнен. Теперь уравниваем водород. Справа в $3H_3PO_4$ его $3 \cdot 3 = 9$ атомов. Слева в $5HNO_3$ — 5 атомов. Не хватает $9 - 5 = 4$ атомов. Значит, нужно взять 2 молекулы воды.
$3P + 5HNO_3 + 2H_2O \rightarrow 3H_3PO_4 + 5NO$
Проверка по кислороду: слева $5 \cdot 3 + 2 \cdot 1 = 17$, справа $3 \cdot 4 + 5 \cdot 1 = 12 + 5 = 17$. Баланс верный.
Ответ: $3P + 5HNO_3(\text{разб.}) + 2H_2O = 3H_3PO_4 + 5NO \uparrow$
е) очень разбавленная азотная кислота + натрий
Решение:
Натрий — очень активный металл. В реакции с очень разбавленной азотной кислотой происходит глубокое восстановление азота до низшей степени окисления -3 с образованием нитрата аммония ($NH_4NO_3$). Также образуется нитрат натрия ($NaNO_3$) и вода.
Схема окислительно-восстановительной реакции:
$\overset{0}{Na} + H\overset{+5}{N}O_3 \rightarrow \overset{+1}{Na}NO_3 + \overset{-3}{N}H_4NO_3 + H_2O$
Составим электронный баланс:
$Na^0 - 1e^- \rightarrow Na^{+1} \quad | \ 8 \quad$ (окисление, Na – восстановитель)
$N^{+5} + 8e^- \rightarrow N^{-3} \quad | \ 1 \quad$ (восстановление, $N^{+5}$ – окислитель)
Ставим коэффициент 8 перед соединениями натрия и 1 перед нитратом аммония.
$8Na + HNO_3 \rightarrow 8NaNO_3 + NH_4NO_3 + H_2O$
Считаем азот справа: 8 атомов в $8NaNO_3$ и 2 атома в $NH_4NO_3$ (один $N^{-3}$ и один $N^{+5}$). Всего $8 + 2 = 10$ атомов. Ставим 10 перед $HNO_3$.
$8Na + 10HNO_3 \rightarrow 8NaNO_3 + NH_4NO_3 + H_2O$
Уравниваем водород: слева 10 атомов. Справа 4 атома в $NH_4^+$. Не хватает $10 - 4 = 6$ атомов. Ставим 3 перед $H_2O$.
$8Na + 10HNO_3 \rightarrow 8NaNO_3 + NH_4NO_3 + 3H_2O$
Проверка по кислороду: слева $10 \cdot 3 = 30$, справа $8 \cdot 3 + 3 + 3 \cdot 1 = 24 + 3 + 3 = 30$. Баланс верный.
Ответ: $8Na + 10HNO_3(\text{оч. разб.}) = 8NaNO_3 + NH_4NO_3 + 3H_2O$
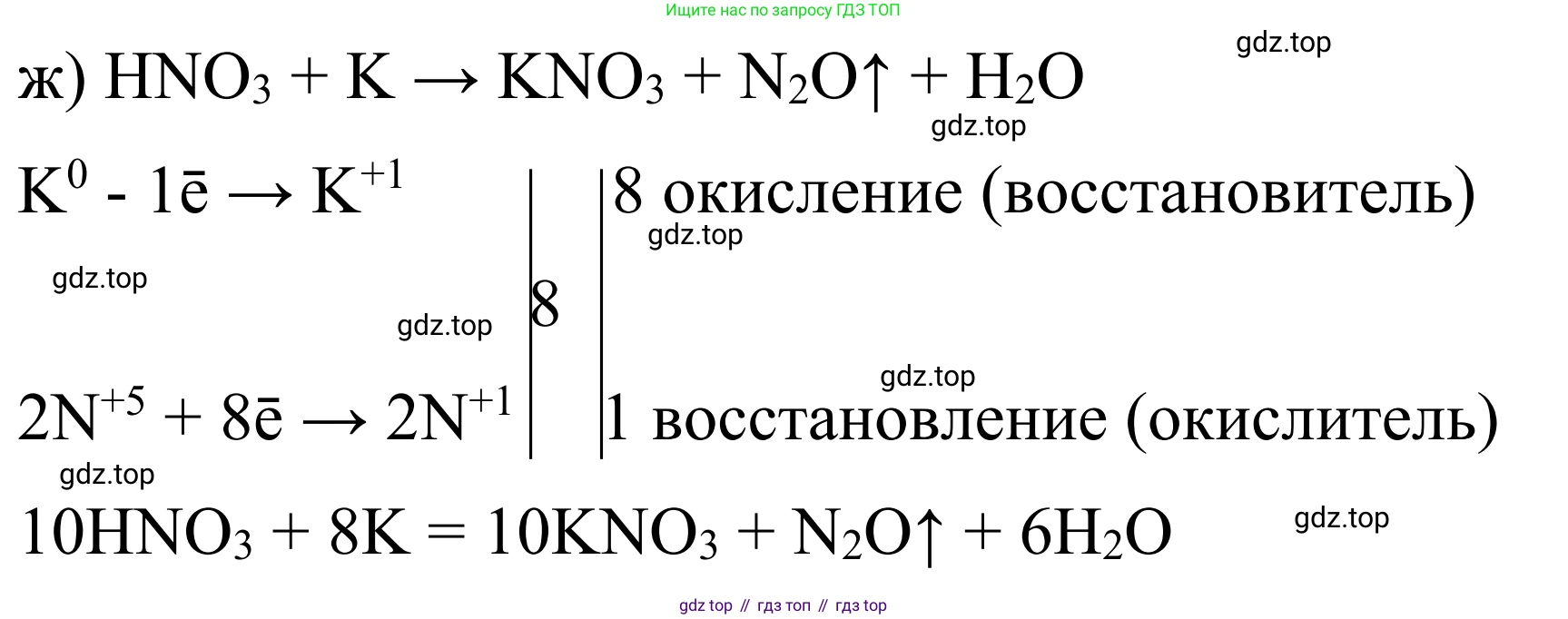
ж) концентрированная азотная кислота + калий
Решение:
Калий — очень активный щелочной металл. Однако, с концентрированной азотной кислотой даже активные металлы образуют в качестве продукта восстановления азота преимущественно диоксид азота ($NO_2$). Также образуются нитрат калия ($KNO_3$) и вода.
Схема окислительно-восстановительной реакции:
$\overset{0}{K} + H\overset{+5}{N}O_3 \rightarrow \overset{+1}{K}NO_3 + \overset{+4}{N}O_2 + H_2O$
Составим электронный баланс:
$K^0 - 1e^- \rightarrow K^{+1} \quad | \ 1 \quad$ (окисление, K – восстановитель)
$N^{+5} + 1e^- \rightarrow N^{+4} \quad | \ 1 \quad$ (восстановление, $N^{+5}$ – окислитель)
Коэффициенты равны 1. Ставим их перед $K$ и $NO_2$.
$K + HNO_3 \rightarrow KNO_3 + NO_2 + H_2O$
Считаем азот справа: 1 атом в $KNO_3$ и 1 в $NO_2$. Всего 2. Ставим 2 перед $HNO_3$.
$K + 2HNO_3 \rightarrow KNO_3 + NO_2 + H_2O$
Уравниваем водород: слева 2, значит, справа нужна 1 молекула воды.
$K + 2HNO_3 \rightarrow KNO_3 + NO_2 + H_2O$
Проверка по кислороду: слева $2 \cdot 3 = 6$, справа $3 + 2 + 1 = 6$. Баланс верный.
Ответ: $K + 2HNO_3(\text{конц.}) = KNO_3 + NO_2 \uparrow + H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 22 расположенного на странице 78 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №22 (с. 78), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















