Номер 28, страница 79 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
8. Азот, фосфор и их соединения. Упражнения и задачи для самостоятельного решения - номер 28, страница 79.
№28 (с. 79)
Условие. №28 (с. 79)
скриншот условия

28. При растворении в кислоте X металлической меди может образоваться газ А или В. Газ А на воздухе переходит в газ В, а тот, в свою очередь, при взаимодействии с сернистым газом переходит в газ А. Определите указанные вещества, напишите уравнения реакций. Рассчитайте, какие объёмы $40 \, \%$-ного раствора (плотность $1,25 \, \text{г/мл}$) и $60 \, \%$-ного раствора (плотность $1,375 \, \text{г/мл}$) кислоты X потребуются для растворения $6,4 \, \text{г}$ меди.
Решение. №28 (с. 79)

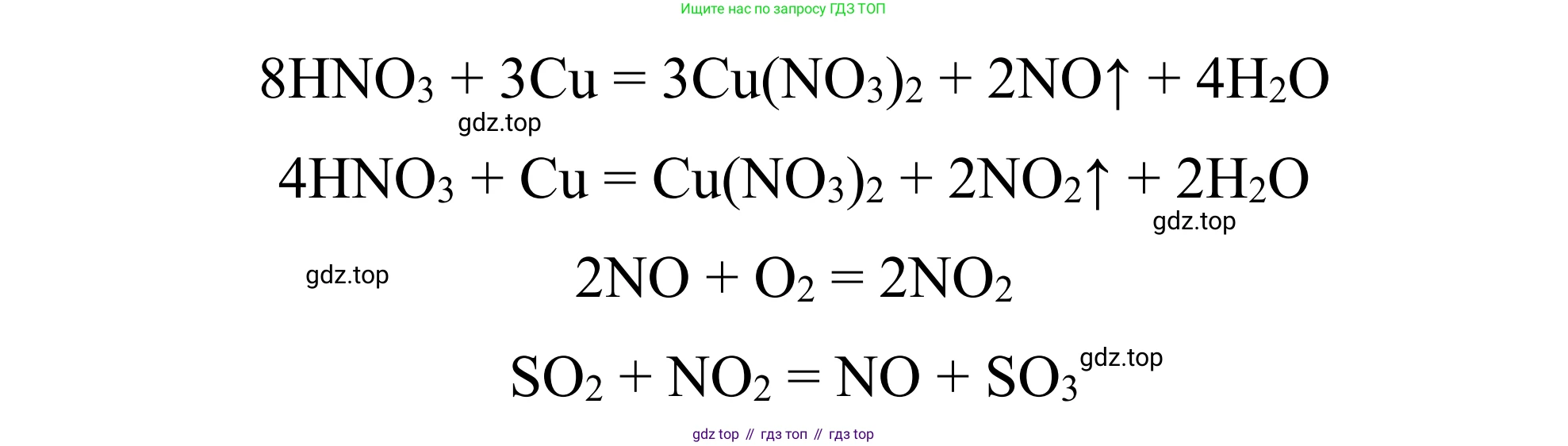
Решение 2. №28 (с. 79)
Исходя из условий задачи, определим вещества. Медь — металл, стоящий в ряду электрохимических напряжений после водорода, поэтому она может растворяться только в кислотах-окислителях, таких как азотная ($HNO_3$) или концентрированная серная ($H_2SO_4$). При реакции с серной кислотой выделяется сернистый газ ($SO_2$), который не подходит под описание превращений газов A и B. Следовательно, кислота X — это азотная кислота ($HNO_3$).
При реакции меди с азотной кислотой могут образовываться оксиды азота. Газ А, который на воздухе переходит в газ В, — это оксид азота(II) ($NO$), который окисляется кислородом воздуха до оксида азота(IV) ($NO_2$).
$2NO (\text{газ А}) + O_2 \rightarrow 2NO_2 (\text{газ В})$
Газ В ($NO_2$) при взаимодействии с сернистым газом ($SO_2$) восстанавливается до газа А ($NO$):
$NO_2 (\text{газ В}) + SO_2 \rightarrow NO (\text{газ А}) + SO_3$
Таким образом:
- Вещество X — азотная кислота, $HNO_3$.
- Газ А — оксид азота(II), $NO$.
- Газ В — оксид азота(IV), $NO_2$.
Уравнения реакций растворения меди в азотной кислоте зависят от ее концентрации. Газ А ($NO$) образуется при реакции с разбавленной кислотой, а газ В ($NO_2$) — с концентрированной.
Уравнения реакций:
1. Растворение меди в разбавленной азотной кислоте с образованием газа А:
$3Cu + 8HNO_3(\text{разб.}) \rightarrow 3Cu(NO_3)_2 + 2NO\uparrow + 4H_2O$
2. Растворение меди в концентрированной азотной кислоте с образованием газа В:
$Cu + 4HNO_3(\text{конц.}) \rightarrow Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O$
3. Превращение газа А в газ В на воздухе:
$2NO + O_2 \rightarrow 2NO_2$
4. Превращение газа В в газ А при взаимодействии с сернистым газом:
$NO_2 + SO_2 \rightarrow NO + SO_3$
Расчет объемов растворов кислоты, необходимых для растворения 6,4 г меди.
Будем считать, что при реакции с 40 %-ным раствором образуется газ А ($NO$), а при реакции с 60 %-ным раствором — газ В ($NO_2$).
1. Расчет для 40 %-ного раствора $HNO_3$ (образуется газ А)
Дано:
$m(Cu) = 6,4 \text{ г}$
$w_1(HNO_3) = 40\% = 0,4$
$\rho_1(\text{р-ра}) = 1,25 \text{ г/мл}$
Найти:
$V_1(\text{р-ра})$ - ?
Решение:
Уравнение реакции: $3Cu + 8HNO_3 \rightarrow 3Cu(NO_3)_2 + 2NO\uparrow + 4H_2O$
1. Найдем количество вещества меди:
$M(Cu) = 64 \text{ г/моль}$
$n(Cu) = \frac{m(Cu)}{M(Cu)} = \frac{6,4 \text{ г}}{64 \text{ г/моль}} = 0,1 \text{ моль}$
2. По уравнению реакции найдем количество вещества азотной кислоты:
$n(HNO_3) = \frac{8}{3} n(Cu) = \frac{8}{3} \times 0,1 \text{ моль} = \frac{0,8}{3} \text{ моль}$
3. Найдем массу чистой азотной кислоты:
$M(HNO_3) = 1 + 14 + 3 \times 16 = 63 \text{ г/моль}$
$m(HNO_3) = n(HNO_3) \times M(HNO_3) = \frac{0,8}{3} \text{ моль} \times 63 \text{ г/моль} = 0,8 \times 21 = 16,8 \text{ г}$
4. Найдем массу 40 %-ного раствора кислоты:
$m_1(\text{р-ра}) = \frac{m(HNO_3)}{w_1(HNO_3)} = \frac{16,8 \text{ г}}{0,4} = 42 \text{ г}$
5. Найдем объем раствора:
$V_1(\text{р-ра}) = \frac{m_1(\text{р-ра})}{\rho_1(\text{р-ра})} = \frac{42 \text{ г}}{1,25 \text{ г/мл}} = 33,6 \text{ мл}$
Ответ: для растворения меди с образованием газа А потребуется 33,6 мл 40 %-ного раствора азотной кислоты.
2. Расчет для 60 %-ного раствора $HNO_3$ (образуется газ В)
Дано:
$m(Cu) = 6,4 \text{ г}$
$w_2(HNO_3) = 60\% = 0,6$
$\rho_2(\text{р-ра}) = 1,375 \text{ г/мл}$
Найти:
$V_2(\text{р-ра})$ - ?
Решение:
Уравнение реакции: $Cu + 4HNO_3 \rightarrow Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O$
1. Количество вещества меди: $n(Cu) = 0,1 \text{ моль}$
2. По уравнению реакции найдем количество вещества азотной кислоты:
$n(HNO_3) = 4 \times n(Cu) = 4 \times 0,1 \text{ моль} = 0,4 \text{ моль}$
3. Найдем массу чистой азотной кислоты:
$m(HNO_3) = n(HNO_3) \times M(HNO_3) = 0,4 \text{ моль} \times 63 \text{ г/моль} = 25,2 \text{ г}$
4. Найдем массу 60 %-ного раствора кислоты:
$m_2(\text{р-ра}) = \frac{m(HNO_3)}{w_2(HNO_3)} = \frac{25,2 \text{ г}}{0,6} = 42 \text{ г}$
5. Найдем объем раствора:
$V_2(\text{р-ра}) = \frac{m_2(\text{р-ра})}{\rho_2(\text{р-ра})} = \frac{42 \text{ г}}{1,375 \text{ г/мл}} \approx 30,55 \text{ мл}$
Ответ: для растворения меди с образованием газа В потребуется 30,55 мл 60 %-ного раствора азотной кислоты.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 28 расположенного на странице 79 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №28 (с. 79), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















