Номер 5, страница 70 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Взаимодействие солей с металлами. Лабораторный опыт 31 - номер 5, страница 70.
№5 (с. 70)
Условие. №5 (с. 70)
скриншот условия
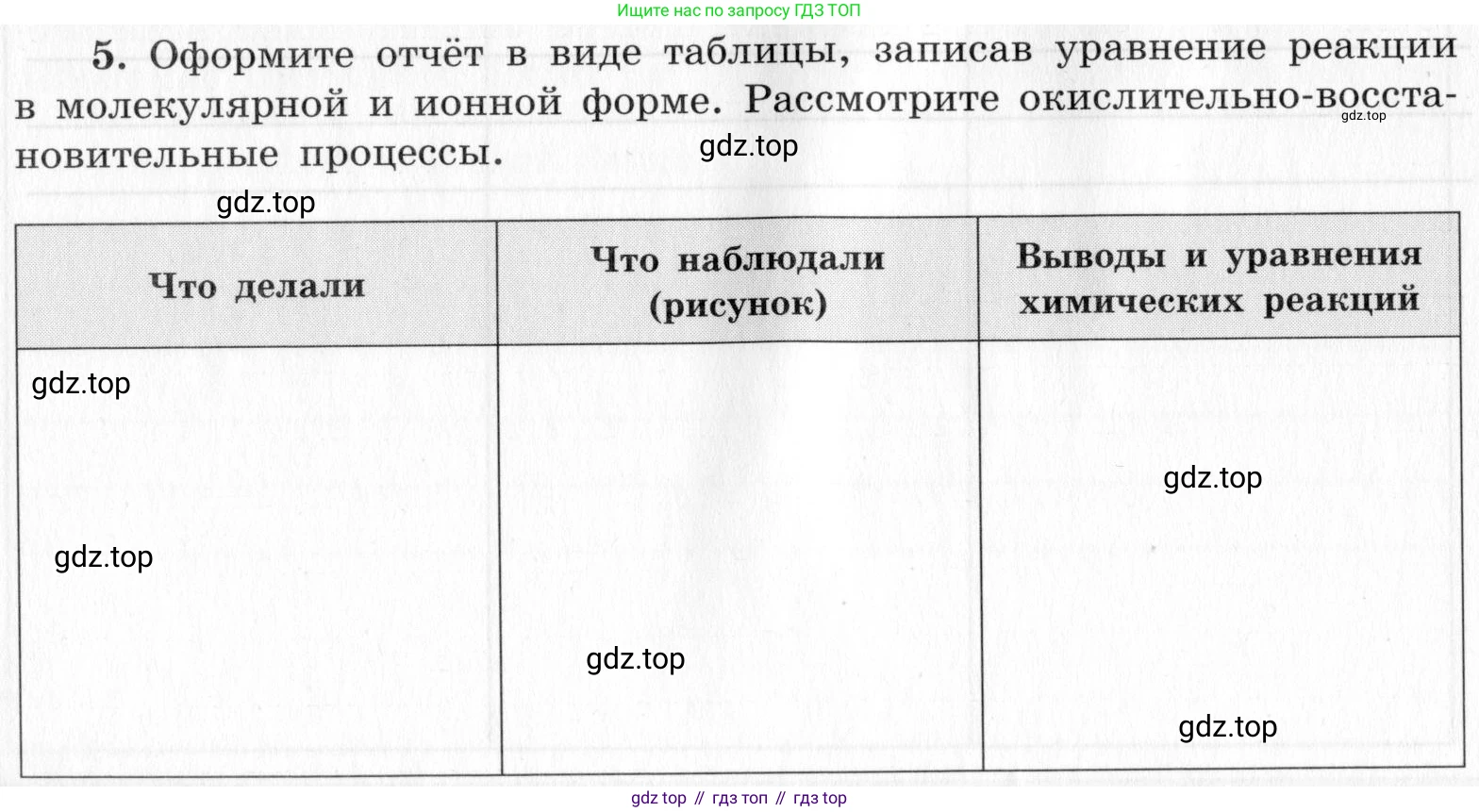
5. Оформите отчёт в виде таблицы, записав уравнение реакции в молекулярной и ионной форме. Рассмотрите окислительно-восстановительные процессы.
| Что делали | Что наблюдали (рисунок) | Выводы и уравнения химических реакций |
|---|---|---|
Решение. №5 (с. 70)

Решение 2. №5 (с. 70)
| Что делали | Что наблюдали (рисунок) | Выводы и уравнения химических реакций |
|---|---|---|
| В пробирку налили водный раствор нитрата серебра ($AgNO_3$) и опустили в него очищенную медную проволоку (или небольшую медную пластинку), чтобы она частично была погружена в раствор. Оставили систему в покое для наблюдения за протеканием реакции. Ответ: | На поверхности медной проволоки (пластинки), погруженной в раствор, наблюдается постепенное образование рыхлых серых кристаллов, которые являются выделившимся металлическим серебром. Раствор, который изначально был бесцветным, со временем приобретает голубую окраску. Это указывает на образование ионов меди ($Cu^{2+}$) в растворе. Также со временем можно заметить, что медная проволока становится тоньше в тех местах, где происходило выделение серебра. Ответ: | Данная реакция является примером однократного замещения, а также окислительно-восстановительной реакции. Медь вытесняет серебро из его солей, так как медь является более активным металлом, чем серебро. Молекулярное уравнение реакции: $Cu(s) + 2AgNO_3(aq) \rightarrow Cu(NO_3)_2(aq) + 2Ag(s)$ Полное ионное уравнение: $Cu(s) + 2Ag^+(aq) + 2NO_3^-(aq) \rightarrow Cu^{2+}(aq) + 2NO_3^-(aq) + 2Ag(s)$ Сокращенное ионное уравнение: $Cu(s) + 2Ag^+(aq) \rightarrow Cu^{2+}(aq) + 2Ag(s)$ Окислительно-восстановительные процессы: Окисление: Медь (элемент $Cu^0$) отдает 2 электрона, повышая свою степень окисления от 0 до +2. Медь выступает в роли восстановителя. $Cu^0 - 2e^- \rightarrow Cu^{2+}$ Восстановление: Ионы серебра ($Ag^+$) принимают 1 электрон, понижая свою степень окисления от +1 до 0. Ионы серебра выступают в роли окислителя. $Ag^+ + e^- \rightarrow Ag^0$ Электронный баланс: Для уравнивания количества отданных и принятых электронов, процесс восстановления ионов серебра необходимо умножить на 2: $Cu^0 - 2e^- \rightarrow Cu^{2+}$ (окисление) $2Ag^+ + 2e^- \rightarrow 2Ag^0$ (восстановление) Суммарное количество отданных и принятых электронов равно 2. Ответ: |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 70 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 70), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.















