Номер 1, страница 113 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Получение аммиака и изучение его свойств. Практическая работа 4 - номер 1, страница 113.
№1 (с. 113)
Условие. №1 (с. 113)
скриншот условия

1. На листке бумаги перемешайте приблизительно равные массы кристаллических хлорида аммония $NH_4Cl$ и гидроксида кальция $Ca(OH)_2$ (например, по два шпателя того и другого вещества).
2. Приготовленную смесь внесите в пробирку на $1/5$ её объёма.
3. Закройте пробирку пробкой с газоотводной стеклянной трубкой и проверьте прибор на герметичность.
4. Закрепите прибор в штативе горизонтально с небольшим наклоном в сторону пробки так, чтобы отверстие пробирки было чуть ниже дна: это связано с тем, что образующиеся капли воды не должны стекать на дно, иначе пробирка может лопнуть.
5. Наденьте сухую пробирку — приёмник газа на газоотводную трубку, направленную вверх.
6. Зажгите спиртовку. Нагревайте пробирку со смесью в пламени спиртовки, соблюдая все правила.
7. Определите наличие аммиака в пробирке-приёмнике. Для этого кусочек универсальной индикаторной бумаги смочите водой и пинцетом поднесите к отверстию пробирки. Что наблюдаете? Запишите уравнение реакции.
8. Прекратите нагревание. Снимите пробирку с аммиаком с газоотводной трубки, не переворачивая её. Конец газоотводной трубки сразу же после снятия с неё пробирки-приёмника закройте кусочком мокрой ваты.
9. Немедленно закройте отверстие пробирки-приёмника пробкой с держателем и опустите пробирку в стакан с водой. Только под водой выньте пробку из отверстия пробирки с помощью держателя.
10. Слегка покачивая пробирку, растворите собранный газ в воде. Когда вода поднимется в пробирку, снова закройте отверстие пробирки пробкой с держателем и выньте пробирку из сосуда.
Оформите отчёт о проделанной работе в виде таблицы.
Что делали
Что наблюдали (рисунок)
Выводы и уравнения реакций
Решение. №1 (с. 113)
Решение 2. №1 (с. 113)
Решение
| Что делали | Что наблюдали (рисунок) | Выводы и уравнения реакций |
|---|---|---|
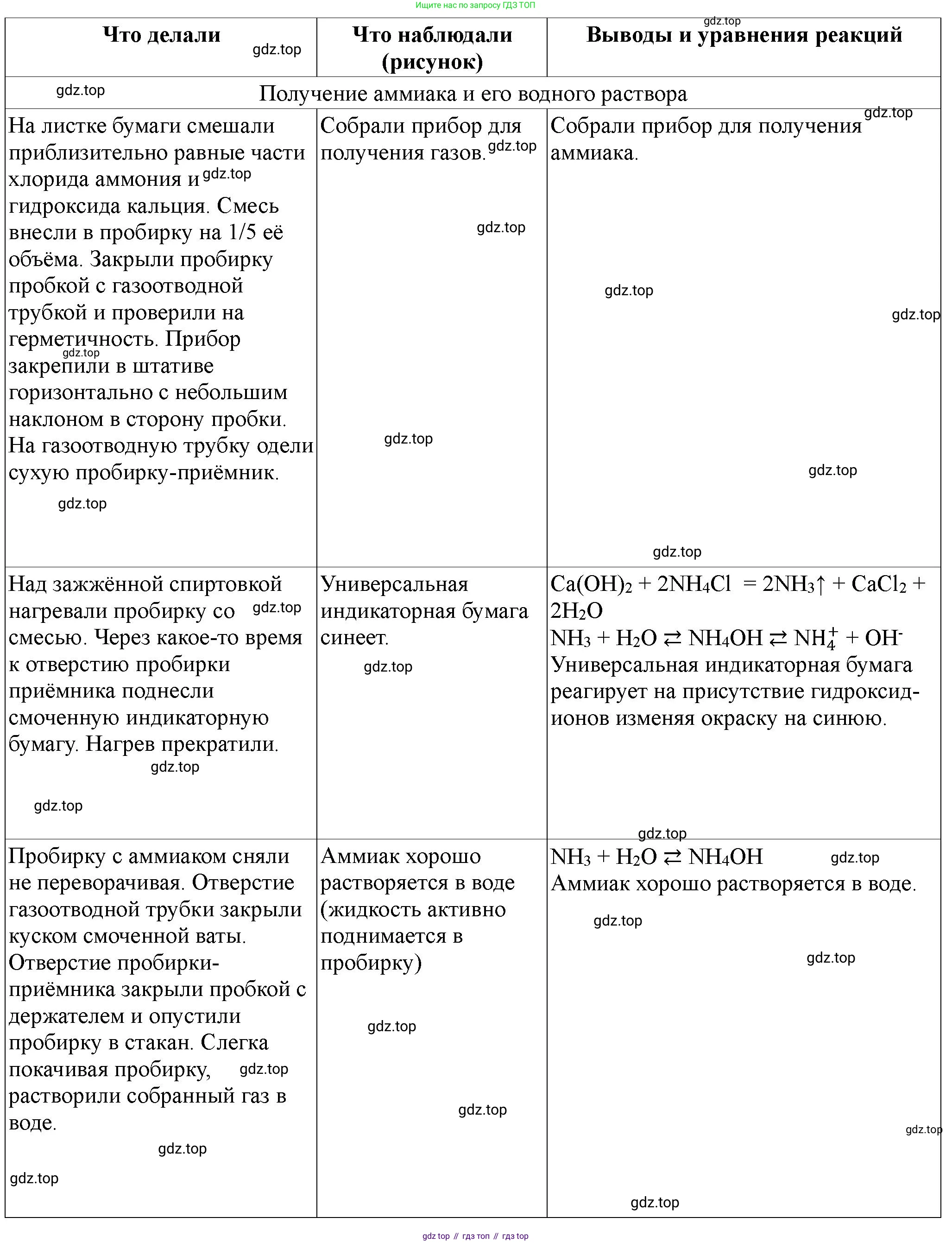
| 1. На листке бумаги перемешайте приблизительно равные массы кристаллических хлорида аммония $NH_4Cl$ и гидроксида кальция $Ca(OH)_2$ (например, по два шпателя того и другого вещества). | Образование однородной белой смеси кристаллических порошков. | Подготовка реагентов для реакции получения аммиака. |
| 2. Приготовленную смесь внесите в пробирку на $1/5$ её объёма. | Смесь равномерно распределена на дне пробирки. | Подготовка к нагреванию. |
| 3. Закройте пробирку пробкой с газоотводной стеклянной трубкой и проверьте прибор на герметичность. | Установка собрана. При проверке (например, легким нагреванием пробирки ладонью и погружением конца газоотводной трубки в воду) пузырьки воздуха не выделяются, что указывает на герметичность. | Обеспечение условий для эффективного сбора газа без потерь. |
| 4. Закрепите прибор в штативе горизонтально с небольшим наклоном в сторону пробки так, чтобы отверстие пробирки было чуть ниже дна: это связано с тем, что образующиеся капли воды не должны стекать на дно, иначе пробирка может лопнуть. | Пробирка закреплена в штативе с небольшим наклоном, так что устье пробирки находится ниже дна. | Предотвращение растрескивания горячей пробирки при контакте с холодными каплями конденсата. |
| 5. Наденьте сухую пробирку – приемник газа на газоотводную трубку, направленную вверх. | Пробирка-приемник надета на газоотводную трубку и направлена отверстием вверх. | Аммиак ($NH_3$) легче воздуха (молярная масса $NH_3 \approx 17 г/моль$, воздуха $\approx 29 г/моль$), поэтому его собирают методом вытеснения воздуха вверх. |
| 6. Зажгите спиртовку. Нагревайте пробирку со смесью в пламени спиртовки, соблюдая все правила. | При нагревании наблюдается выделение газа. На холодных стенках пробирки-приемника могут появиться мелкие капли бесцветной жидкости (воды). | Начало химической реакции получения аммиака и конденсация образующейся воды. |
| 7. Определите наличие аммиака в пробирке-приёмнике. Для этого кусочек универсальной индикаторной бумаги смочите водой и пинцетом поднесите к отверстию пробирки. Что наблюдаете? Запишите уравнение реакции. | Смоченная универсальная индикаторная бумага меняет цвет на синий или зеленый (показывая щелочную среду). Ощущается резкий характерный запах аммиака. | Аммиак — это газ со щелочными свойствами, проявляющимися при растворении в воде. Уравнение реакции получения аммиака: $2NH_4Cl(s) + Ca(OH)_2(s) \xrightarrow{t} CaCl_2(s) + 2NH_3(g) + 2H_2O(g)$ Взаимодействие аммиака с водой (объяснение щелочных свойств): $NH_3(g) + H_2O(l) \rightleftharpoons NH_4OH(aq)$ $NH_4OH(aq) \rightleftharpoons NH_4^+(aq) + OH^-(aq)$ |
| 8. Прекратите нагревание. Снимите пробирку с аммиаком с газоотводной трубки, не переворачивая её. Конец газоотводной трубки сразу же после снятия с неё пробирки-приёмника закройте кусочком мокрой ваты. | Нагревание прекращено. Пробирка-приемник аккуратно снята, не переворачиваясь, и её отверстие немедленно закрыто кусочком мокрой ваты. | Остановка реакции и предотвращение утечки собранного аммиака, так как он легче воздуха. Мокрая вата дополнительно поглощает аммиак из-за его хорошей растворимости в воде. |
| 9. Немедленно закройте отверстие пробирки-приёмника пробкой с держателем и опустите пробирку в стакан с водой. Только под водой выньте пробку из отверстия пробирки с помощью держателя. | При погружении пробирки в воду и удалении пробки под водой, вода резко поднимается в пробирку, образуя "фонтан". | Это явление демонстрирует очень высокую растворимость аммиака в воде, что приводит к быстрому падению давления внутри пробирки и засасыванию воды. |
| 10. Слегка покачивая пробирку, растворите собранный газ в воде. Когда вода поднимется в пробирку, снова закройте отверстие пробирки пробкой с держателем и выньте пробирку из сосуда. | Вода заполняет пробирку почти полностью (или полностью, если весь аммиак растворился), показывая объем поглощенного газа. | Подтверждение высокой растворимости аммиака в воде и образование его водного раствора (нашатырного спирта). |
Ответ: Проведены этапы получения аммиака и изучены его свойства, что подтверждено наблюдениями и уравнениями реакций, представленными в таблице.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 1 расположенного на странице 113 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 113), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.














