Номер 2, страница 114 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Получение аммиака и изучение его свойств. Практическая работа 4 - номер 2, страница 114.
№2 (с. 114)
Условие. №2 (с. 114)
скриншот условия

Изучение химических свойств водного раствора аммиака
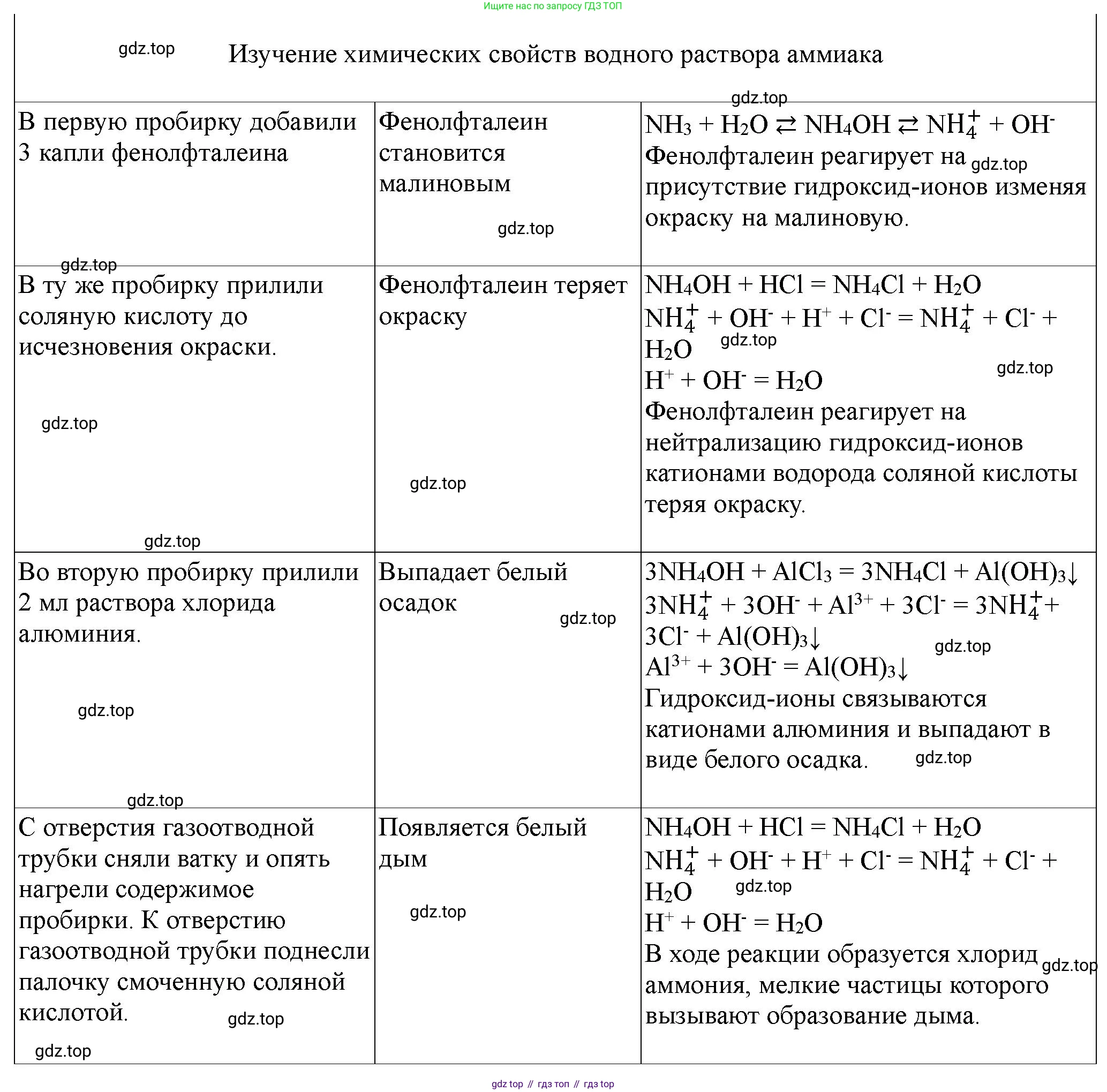
1. Содержимое пробирки с полученным раствором аммиака разделите на две пробирки. В одну добавьте 2–3 капли фенолфталеина. Что наблюдаете?
2. В эту же пробирку прилейте соляную кислоту (или раствор азотной кислоты) до исчезновения окраски. Запишите уравнение реакции в молекулярной и ионной форме.
3. В другую пробирку прилейте 1–2 мл раствора хлорида алюминия. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной форме.
4. Снимите ватку с газоотводной трубки и снова нагрейте пробирку со смесью гидроксида кальция и хлорида аммония.
Поднесите к отверстию газоотводной трубки палочку, смоченную соляной кислотой. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной форме.
Разберите установку и приведите в порядок рабочее место.
Оформите отчёт о проделанной работе в виде таблицы.
Что делали
Что наблюдали
(рисунок)
Выводы и уравнения
реакций
2. Приготовим смесь веществ
3. Закройте пробирку пробкой с газоотводной трубкой и проверьте прибор на герметичность.
4. Закрепите прибор в штативе горизонтально с небольшим наклоном в сторону пробирки так, чтобы отверстие пробирки было чуть выше.
5. Наденьте сухую пробирку – приемник газа на газоотводную трубку, направленную вверх.
6. Зажгите спиртовку. Нагревайте пробирку со смесью в пламени спиртовки, соблюдая все правила.
7. Определите наличие аммиака в пробирке-приемнике. Для этого кусочек универсальной индикаторной бумаги смочите водой и пинцетом поднесите к отверстию пробирки. Что наблюдаете? Запишите уравнение реакции.
8. Прекратите нагревание. Снимите пробирку с аммиаком с газоотводной трубки, не переворачивая ее. Конец газоотводной трубки приёмника закройте кусочком ваты.
Решение. №2 (с. 114)
Решение 2. №2 (с. 114)
1. Содержимое пробирки с полученным раствором аммиака разделите на две пробирки. В одну добавьте 2–3 капли фенолфталеина. Что наблюдаете?
При добавлении 2–3 капель фенолфталеина в раствор аммиака наблюдается изменение цвета раствора на малиновый (пурпурно-красный). Это происходит потому, что водный раствор аммиака является слабым основанием ($\text{NH}_3 \cdot \text{H}_2\text{O} \rightleftharpoons \text{NH}_4^+ + \text{OH}^-$), и фенолфталеин проявляет свою характерную окраску в щелочной среде при значении pH выше 8.2.
Ответ: Наблюдается изменение цвета раствора на малиновый.
2. В эту же пробирку прилейте соляную кислоту (или раствор азотной кислоты) до исчезновения окраски. Запишите уравнение реакции в молекулярной и ионной форме.
При добавлении соляной кислоты в пробирку с малиновым раствором наблюдается постепенное обесцвечивание раствора до полного исчезновения малиновой окраски. Это происходит из-за реакции нейтрализации между слабым основанием (гидроксидом аммония) и сильной кислотой (соляной кислотой), в результате чего снижается концентрация гидроксид-ионов ($\text{OH}^-$), и pH раствора становится кислым или нейтральным, за пределами диапазона индикации фенолфталеина.
Молекулярное уравнение реакции:
$\text{NH}_4\text{OH} (\text{aq}) + \text{HCl} (\text{aq}) \rightarrow \text{NH}_4\text{Cl} (\text{aq}) + \text{H}_2\text{O} (\text{l})$
Полное ионное уравнение реакции:
$\text{NH}_4^+ (\text{aq}) + \text{OH}^- (\text{aq}) + \text{H}^+ (\text{aq}) + \text{Cl}^- (\text{aq}) \rightarrow \text{NH}_4^+ (\text{aq}) + \text{Cl}^- (\text{aq}) + \text{H}_2\text{O} (\text{l})$
Краткое ионное уравнение реакции:
$\text{OH}^- (\text{aq}) + \text{H}^+ (\text{aq}) \rightarrow \text{H}_2\text{O} (\text{l})$
Ответ: Наблюдается обесцвечивание раствора. Уравнения реакции приведены выше.
3. В другую пробирку прилейте 1–2 мл раствора хлорида алюминия. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной форме.
При добавлении раствора хлорида алюминия ($\text{AlCl}_3$) в пробирку с водным раствором аммиака ($\text{NH}_4\text{OH}$) наблюдается образование белого желеобразного осадка. Этот осадок представляет собой гидроксид алюминия ($\text{Al(OH)}_3$), который практически нерастворим в воде. Аммиачная вода, будучи слабым основанием, осаждает гидроксиды металлов, чьи гидроксиды нерастворимы в воде и не образуют комплексных соединений с избытком аммиака (в отличие от, например, гидроксида меди(II) или цинка).
Молекулярное уравнение реакции:
$\text{AlCl}_3 (\text{aq}) + 3\text{NH}_4\text{OH} (\text{aq}) \rightarrow \text{Al(OH)}_3 \downarrow (\text{s}) + 3\text{NH}_4\text{Cl} (\text{aq})$
Полное ионное уравнение реакции:
$\text{Al}^{3+} (\text{aq}) + 3\text{Cl}^- (\text{aq}) + 3\text{NH}_4^+ (\text{aq}) + 3\text{OH}^- (\text{aq}) \rightarrow \text{Al(OH)}_3 \downarrow (\text{s}) + 3\text{NH}_4^+ (\text{aq}) + 3\text{Cl}^- (\text{aq})$
Краткое ионное уравнение реакции:
$\text{Al}^{3+} (\text{aq}) + 3\text{OH}^- (\text{aq}) \rightarrow \text{Al(OH)}_3 \downarrow (\text{s})$
Ответ: Наблюдается образование белого желеобразного осадка. Уравнения реакции приведены выше.
4. Снимите ватку с газоотводной трубки и снова нагрейте пробирку со смесью гидроксида кальция и хлорида аммония. Поднесите к отверстию газоотводной трубки палочку, смоченную соляной кислотой. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной форме.
Нагревание смеси гидроксида кальция ($\text{Ca(OH)}_2$) и хлорида аммония ($\text{NH}_4\text{Cl}$) приводит к выделению газообразного аммиака ($\text{NH}_3$). Это является лабораторным методом получения аммиака.
Уравнение реакции получения аммиака (молекулярное):
$\text{Ca(OH)}_2 (\text{s}) + 2\text{NH}_4\text{Cl} (\text{s}) \xrightarrow{t} \text{CaCl}_2 (\text{s}) + 2\text{NH}_3 \uparrow (\text{g}) + 2\text{H}_2\text{O} (\text{l})$
Полное ионное уравнение (учитывая, что реакция протекает в твердой фазе при нагревании, но по сути сводится к взаимодействию ионов):
$2\text{NH}_4^+ (\text{s}) + 2\text{Cl}^- (\text{s}) + \text{Ca}^{2+} (\text{s}) + 2\text{OH}^- (\text{s}) \xrightarrow{t} \text{Ca}^{2+} (\text{s}) + 2\text{Cl}^- (\text{s}) + 2\text{NH}_3 \uparrow (\text{g}) + 2\text{H}_2\text{O} (\text{l})$
Краткое ионное уравнение (суть процесса - взаимодействие ионов аммония с гидроксид-ионами при нагревании):
$\text{NH}_4^+ (\text{s}) + \text{OH}^- (\text{s}) \xrightarrow{t} \text{NH}_3 \uparrow (\text{g}) + \text{H}_2\text{O} (\text{l})$
При поднесении палочки, смоченной соляной кислотой, к отверстию газоотводной трубки, наблюдается образование белого дыма. Этот дым состоит из мельчайших твердых частиц хлорида аммония ($\text{NH}_4\text{Cl}$). Реакция происходит между газообразным аммиаком ($\text{NH}_3$), выходящим из трубки, и парами хлороводорода ($\text{HCl}$), испаряющимися с палочки. Эта реакция является качественной реакцией на аммиак.
Уравнение реакции между газообразным аммиаком и хлороводородом (молекулярное):
$\text{NH}_3 (\text{g}) + \text{HCl} (\text{g}) \rightarrow \text{NH}_4\text{Cl} (\text{s})$
Данная реакция происходит между двумя газами с образованием твердого ионного соединения. В таких случаях обычно используется молекулярная форма уравнения. Запись в ионной форме для газофазных реакций не является стандартной, поскольку нет растворителя для ионизации, но продукт является ионным соединением ($\text{NH}_4^+$ и $\text{Cl}^-$).
Ответ: Наблюдается образование белого дыма. Уравнения реакции приведены выше.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 114 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 114), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.















