Номер 2, страница 124 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 6. Углерод и кремний. Параграф 35. Угольная кислота и её соли. Круговорот углерода в природе. Вопросы в начале параграфа - номер 2, страница 124.
№2 (с. 124)
Условие. №2 (с. 124)
скриншот условия
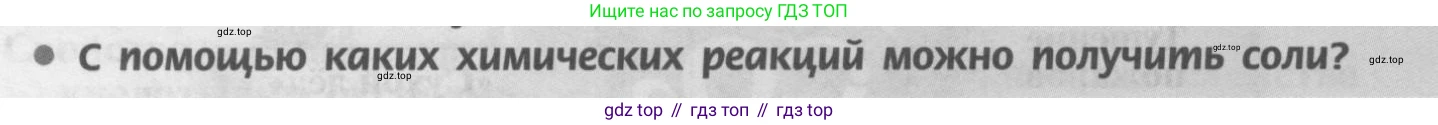
● С помощью каких химических реакций можно получить соли?
Решение. №2 (с. 124)

Решение 2. №2 (с. 124)
Соли можно получить множеством способов, вступая в реакции между различными классами неорганических соединений. Ниже перечислены основные типы таких химических реакций.
1. Взаимодействие кислоты с основанием (реакция нейтрализации)
При реакции кислоты с основанием образуются соль и вода. Это один из самых распространенных методов.
Пример: Серная кислота реагирует с гидроксидом калия с образованием сульфата калия и воды.
$H_2SO_4 + 2KOH \rightarrow K_2SO_4 + 2H_2O$
Ответ: Кислота + Основание → Соль + Вода. Например, $HCl + NaOH \rightarrow NaCl + H_2O$.
2. Взаимодействие кислоты с основным оксидом
Кислота реагирует с оксидом металла, в результате чего образуются соль и вода.
Пример: Азотная кислота реагирует с оксидом магния, образуя нитрат магния и воду.
$2HNO_3 + MgO \rightarrow Mg(NO_3)_2 + H_2O$
Ответ: Кислота + Основный оксид → Соль + Вода. Например, $H_2SO_4 + CuO \rightarrow CuSO_4 + H_2O$.
3. Взаимодействие основания с кислотным оксидом
Растворимое основание (щелочь) реагирует с оксидом неметалла, образуя соль и воду.
Пример: Гидроксид кальция (гашеная известь) реагирует с сернистым газом с образованием нерастворимого сульфита кальция и воды.
$Ca(OH)_2 + SO_2 \rightarrow CaSO_3 \downarrow + H_2O$
Ответ: Щелочь + Кислотный оксид → Соль + Вода. Например, $2NaOH + CO_2 \rightarrow Na_2CO_3 + H_2O$.
4. Взаимодействие основного оксида с кислотным оксидом
При сплавлении основного и кислотного оксидов образуется соль.
Пример: Оксид натрия реагирует с оксидом серы(VI) с образованием сульфата натрия.
$Na_2O + SO_3 \rightarrow Na_2SO_4$
Ответ: Основный оксид + Кислотный оксид → Соль. Например, $CaO + SiO_2 \xrightarrow{t} CaSiO_3$.
5. Взаимодействие металла с кислотой
Металлы, стоящие в ряду активности до водорода, вытесняют его из растворов кислот (кроме концентрированных серной и азотной), образуя соль и водород.
Пример: Железо реагирует с разбавленной серной кислотой, образуя сульфат железа(II) и водород.
$Fe + H_2SO_4(разб.) \rightarrow FeSO_4 + H_2 \uparrow$
Ответ: Металл + Кислота → Соль + Водород. Например, $Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$.
6. Взаимодействие металла с неметаллом
При непосредственном взаимодействии (часто при нагревании) металла и неметалла образуется соль.
Пример: Натрий реагирует с серой при нагревании, образуя сульфид натрия.
$2Na + S \xrightarrow{t} Na_2S$
Ответ: Металл + Неметалл → Соль. Например, $2Fe + 3Cl_2 \xrightarrow{t} 2FeCl_3$.
7. Взаимодействие металла с солью
Более активный металл вытесняет менее активный из раствора его соли.
Пример: Цинк вытесняет свинец из раствора нитрата свинца(II).
$Zn + Pb(NO_3)_2 \rightarrow Zn(NO_3)_2 + Pb \downarrow$
Ответ: Более активный металл + Соль менее активного металла → Новая соль + Менее активный металл. Например, $Fe + CuSO_4 \rightarrow FeSO_4 + Cu \downarrow$.
8. Взаимодействие кислоты с солью
Реакция происходит, если образуется осадок, газ или более слабая кислота.
Пример: Серная кислота реагирует с хлоридом бария, образуя нерастворимый сульфат бария.
$H_2SO_4 + BaCl_2 \rightarrow BaSO_4 \downarrow + 2HCl$
Ответ: Кислота + Соль → Новая кислота + Новая соль. Например, $2HCl + Na_2CO_3 \rightarrow 2NaCl + H_2O + CO_2 \uparrow$.
9. Взаимодействие щелочи с солью
Реакция идет, если один из продуктов выпадает в осадок (нерастворимое основание или нерастворимая соль).
Пример: Гидроксид калия реагирует с хлоридом железа(III), образуя бурый осадок гидроксида железа(III).
$3KOH + FeCl_3 \rightarrow Fe(OH)_3 \downarrow + 3KCl$
Ответ: Щелочь + Соль → Новое основание + Новая соль. Например, $2NaOH + CuSO_4 \rightarrow Cu(OH)_2 \downarrow + Na_2SO_4$.
10. Взаимодействие двух солей
Реакция обмена между двумя растворимыми солями протекает, если в результате образуется нерастворимый продукт (осадок).
Пример: Хлорид бария реагирует с сульфатом натрия с образованием белого осадка сульфата бария.
$BaCl_2 + Na_2SO_4 \rightarrow BaSO_4 \downarrow + 2NaCl$
Ответ: Соль 1 + Соль 2 → Соль 3 + Соль 4 (при условии, что одна из новых солей нерастворима). Например, $AgNO_3 + KCl \rightarrow AgCl \downarrow + KNO_3$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 124 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 124), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















